欢迎您访问爱非克(深圳)生物科技有限公司
关键词:AKK菌、AKK菌格林汁
炎症性肠病(IBD),包括溃疡性结肠炎(UC)和克罗恩病(CD),在过去50年中已发展成为一种全球性疾病,在全球范围内的发病率和流行率不断增加。
与粘膜免疫和宿主代谢相关的肠道微生物群可能是IBD发病机制中最关键的环境因素,Marion-Letellier等人证实,肠道微生物群在IBD患者结肠炎的严重程度和进展中起着关键作用。
AKK菌是疣微菌门的代表细菌,占人类肠道微生物群落的1-5%,代谢紊乱中通过肠道微生物与宿主之间的相互作用在维持肠道屏障功能、宿主代谢和其他生物功能方面发挥重要作用。
研究发现,炎症性肠病患者的AKK菌的丰度降低,表明AKK菌可能在防止炎症性肠病IBD中发生肠道损伤方面发挥关键作用。
AKK菌给药,能够使血清和结肠组织中炎症细胞因子和趋化因子(TNF-α、IL1α、IL6、IL12A、MIP-1A、G-CSF和KC)的水平降低,通过减轻体重减轻、结肠长度缩短和组织病理学评分以及屏障功能增强来证明改善炎症性肠病IBD。
研究内容
5周龄的无特定病原体(SPF)雄性C57BL/6小鼠在SPF条件下常规饲养,并在小鼠6-7周龄时进行实验。24只小鼠随机分为三组(每组n =8):正常对照组(CP组)、实验模型组(DP组)和A. muciniphila组(AKK组)。AKK组(DSS + A. muciniphila)中的小鼠每天口服管饲0.2 ml A. muciniphila MucT (ATTC BAA835)(3 × 109 CFU)一次,DP组(DSS + PBS)和CP组(水+ PBS)中的小鼠则给予等量的厌氧无菌PBS,持续14天(第-7天至第7天)。在第0天,AKK组和DP组的小鼠口服含2%(wt/vol)DSS的饮用水,持续7天(第0天至第6天) ,然后正常饮水2天。同时,CP组小鼠给予正常饮水9天(第0-8天)。在整个实验过程中记录小鼠体重,并在第0天和第8天收集粪便样本。通过异硫氰酸荧光素偶联葡聚糖(FITC-葡聚糖)法测定肠道通透性,使用结肠炎的疾病活动指数(DAI)评估测量结肠炎的严重程度。在实验结束时(第8天),所有小鼠在收集血清和结肠段后被安乐死。收集的结肠段用于组织病理学、免疫荧光分析以及结肠mRNA表达的测定,收集血清进行参数分析,粪便用于微生物群落分析以及短链脂肪酸定量分析。
研究结果
A. muciniphila减轻DSS诱导的结肠炎
DSS模型建立期间的体重减轻可用作结肠炎严重程度的度量。从第2天开始,DP组小鼠的体重持续下降,而AKK组小鼠的体重减轻有显著改善,尽管第6天有明显下降。实验中,与DP组小鼠相比,AKK组小鼠的体重减轻减少。在结肠炎模型中,疾病严重程度通常与肠道炎症引起的结肠长度缩短有关。在DSS暴露7天后,DP组小鼠的结肠比CP组和AKK组更短。重要的是,给予DSS会导致小鼠体重减轻和血性腹泻,这些因素是与人类UC的某些临床特征相似的炎症相关参数,可用于计算DAI评分。在该研究中,随着DSS给药时间的延长,DP组小鼠的评分明显高于CP组和AKK组。
所有化学诱导的结肠炎模型,包括口服DSS,都是从破坏上皮屏障开始的。H&E结肠染色结果显示DSS诱导的结肠炎导致溃疡延长、隐窝破坏和透壁炎症浸润,粘膜结构几乎不完整。然而,在用A. muciniphila治疗的小鼠中,组织学损伤得到改善,这可以通过保留的粘膜结构显示出局灶性糜烂和轻度/中度粘膜炎症浸润来证明。使用组织病理学评分(0-6)系统评估肠粘膜结构(0-3) 和炎症浸润(0-3),结果显示,用A. muciniphila治疗的小鼠的得分显著低于仅接受DSS处理的小鼠。
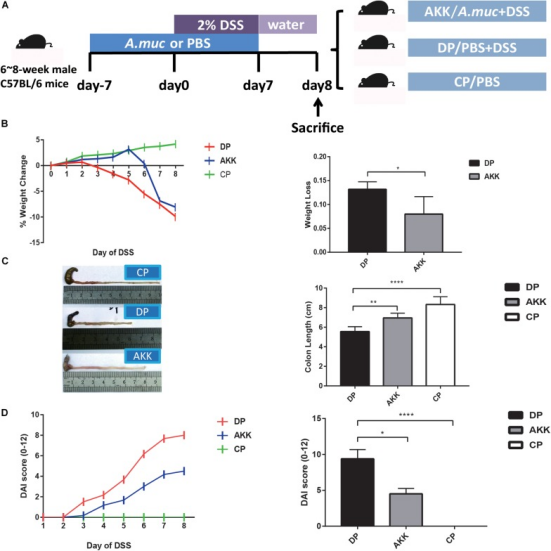
图 Akkermansia muciniphila减轻DSS诱导的结肠损伤
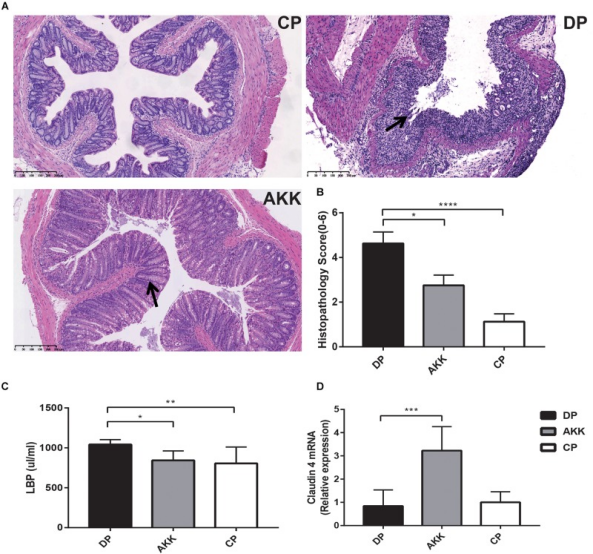
图 Akkermansia muciniphila改善小鼠结肠黏膜屏障损伤
A. muciniphila改善小鼠结肠粘膜屏障损伤
结肠上皮破坏和炎症活动增加了肠道细菌易位的风险,进而加重结肠炎的严重程度。因此,通过ELISA测量血清脂多糖(LPS)结合蛋白(LBP)以评估细菌易位和结肠炎活性,结果显示DP组血清LBP水平高于CP组和AKK组。
肠黏膜屏障破坏与结肠炎进展有关。通过定量PCR和免疫荧光测定结肠中连接蛋白(occludin、ZO-1和claudin-4)的表达,结果发现,DP组结肠组织中Claudin-4 mRNA的表达降低,相比之下,AKK组的水平上调。值得注意的是,与CP组相比,DP组结肠中occludin mRNA的表达下调。然而,在AKK和DP组之间没有发现occludin和ZO-1 mRNA表达的显著差异。DP组中的结肠组织呈现出增加的TJ结构缺陷,隐窝被破坏和顶端区域被破坏,而A. muciniphila给药稳定了粘膜完整性,导致occludin和ZO-1的平滑和连续定位。
此外,大麻素受体CB1和CB2与维持肠道通透性和血浆LPS水平呈正相关。与血清LBP水平一致,DSS处理后这两个标记物(CB1和CB2)的表达显著增加,而在用A. muciniphila治疗的小鼠中表达下调。值得注意的是,FITC-葡聚糖分析显示,与DP组相比,AKK组小鼠的肠道通透性降低,表明A. muciniphila治疗后屏障功能增加。
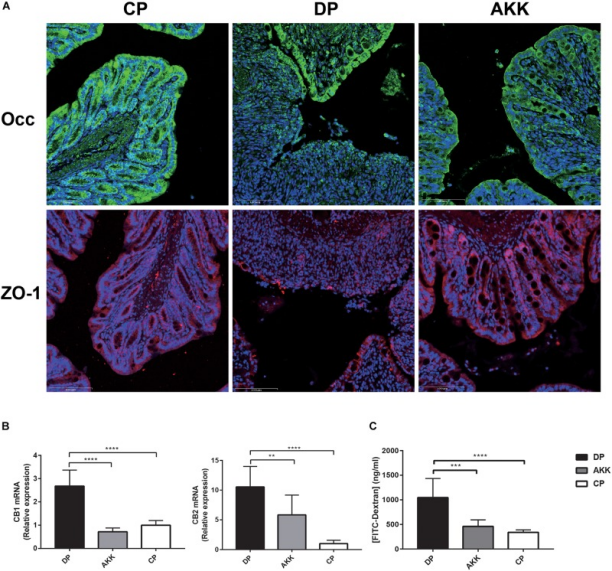
图3 Akkermansia muciniphila增强肠道屏障功能
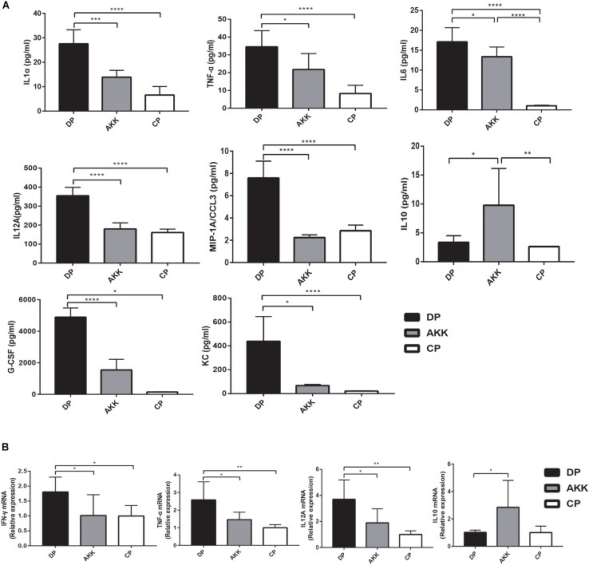
图4 Akkermansia muciniphila表现出全身和肠道抗炎作用
A. muciniphila治疗导致全身和肠道抗炎
为探索A. muciniphila治疗是否可以通过调节炎症来缓解结肠炎,该研究检测了血清细胞因子和远端结肠组织中细胞因子的表达。在仅DSS处理的小鼠中(DP vs. CP)观察到血清细胞因子增加,包括促炎细胞因子TNF-α、IL1α、IL6和IL12A,以及趋化因子MIP-1A、G-CSF和KC。在AKK组中,这些细胞因子显著下调,其水平与CP组相似。此外,在结肠组织炎症表达中也发现了类似的结果。与CP组相比,DP组TNF-α、IL12A和INFγ的表达水平显著上调。相比之下,与DP组相比,口服A. muciniphila后TNF-α、IL12A和INFγ的表达下调,并且几乎降至正常水平。IL1α、IL6和MIP-1A显示出类似的下降趋势。此外,用A. muciniphila治疗小鼠后血清和结肠组织中免疫调节细胞因子IL10的表达水平增加。
A. muciniphila减轻DSS诱导的微生物群失调并重塑肠道微生物群落
肠道微生物是肠道炎症的重要因素。为进一步探索A. muciniphila治疗对DSS诱导的结肠炎小鼠的保护作用,该研究对三组的粪便样本进行16S rRNA测序分析以评估肠道微生物群的变化。三组的稀少曲线反映了粪便分析的测序深度,总共获得1285692 reads(AKK = 431984,CP = 427244,DP = 426464)用于进一步分析,11982个已识别的OTUs(AKK = 3853,CP = 4530,DP = 3599)聚类相似度截止点为97%。与CP组相比,DSS处理小鼠(DP组)的粪便微生物组表现出降低的α多样性,这反映在观察到的物种和Ace、Chao1和香农指数降低。在用A. muciniphila处理的小鼠中(AKK vs. DP),香农指数显著高于未用A. muciniphila处理的小鼠。接下来,该研究进行加权UniFrac PCoA分析肠道微生物群落(β多样性)中物种复杂性和结构改变的差异,结果显示三组之间的β多样性存在显著差异,DP组样品与CP组样品分开。同样,AKK和DP组样品的微生物群清楚地分为两个集群,表明连续施用A. muciniphila缓解了DSS诱导的肠道微生物群失调。
IBD患者中细菌类群的相对丰度发生改变。因此,该研究使用Wilcoxon秩和检验来比较三组之间的相对分类群丰度。在门水平上,与CP组相比,由于DSS处理,Firmicutes的丰度降低,Bacteroidetes的丰度增加 (F/B < 1)。在连续施用A. muciniphila后,Firmicutes的比例显著增加,Bacteroidetes减少。此外,由于治疗,Bacteroidetes的丰度也增加。在科层面,与DP组相比,AKK组瘤胃球菌科的相对丰度增加,而Rikenellaceae和Enterobacteriaceae的相对丰度有所降低,但没有显著差异。在属水平上,AKK组粪便菌群中Oscillibacter的丰度显著高于DP组和CP组。
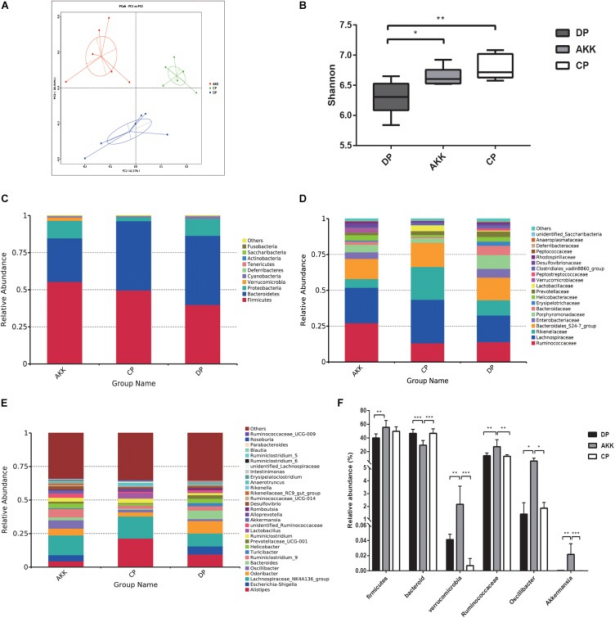
图左 A. muciniphila缓解了DSS诱导的微生物群失调
图右 Akkermansia muciniphila重塑了肠道微生物群落
该研究进行LEfSe分析,以从三组之间的微生物丰度分析中探索预后生物标记物。结果发现,A. muciniphila治疗后Clostridia、Firmicutes、Ruminococcaceae、Oscillibacter、Verrucomicrobia和Akkermansia的丰度增加,Bacteroidetes的丰度减少。有趣的是,由于DSS处理,粪便菌群Enterobacteriales、Escherichia Shigella和Erysipelotrichales富集,并且Lactobacillales、Rikenellaceae和Lachnospiraceae减少。至于京都基因和基因组百科全书(KEGG)代谢途径,在DP和AKK组之间观察到了几个预测的功能差异,例如NOD样受体信号通路、糖胺聚糖降解途径和脂质代谢途径
在该研究中,从三组的24个粪便样本中共鉴定出六种短链脂肪酸(SCFA),包括乙酸、丙酸、异丁酸、丁酸、2-甲基丁酸和戊酸。与DP组相比,AKK组的乙酸、丙酸、异丁酸和丁酸的水平显著升高。然而,在A. muciniphila处理下,2-甲基丁酸和戊酸的水平没有变化。

图 在三组中观察到的短链脂肪酸(SCFA)分布
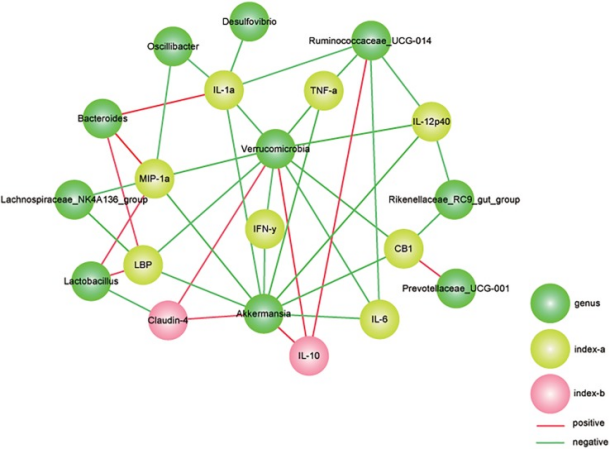
图 肠道菌群与结肠炎参数的相关性分析
相关性分析表明A. muciniphila修正的肠道微生物群在DSS诱导的结肠炎的进展中发挥重要作用
通过肠道细菌丰度和结肠炎参数之间的相关性分析验证改变的微生物群落与结肠炎严重程度的相关性,结果显示,A. muciniphila修正细菌的相对丰度与肠道屏障标志物和相关的炎性细胞因子有关。作为代表性结肠炎严重程度标记物之一,TNF-α与Verrucomicrobia、Ruminococcaceae_UCG-014和Akkermansia呈负相关。此外,主要促炎细胞因子IL12(p40)与Ruminococcaceae_UCG-014、Verrucomicrobia、Akkermansia和 Rikenellaceae_RC9_gut_group的种群密度呈负相关。值得注意的是,该研究发现Verrucomicrobia在AKK组中显著丰富,并且与所有测试的肠道屏障标志物(claudin-4、LBP和CB1)和炎性细胞因子(包括TNF-α、IFN-γ、IL12(p40)、IL1α和IL6)显著负相关。相比之下,在DP组中富集的Bacteroides与MIP-1α、IL1α和LBP呈正相关。抗炎细胞因子 IL10,因A. muciniphila给药而上调,与Verrucomicrobia、Ruminococcaceae_UCG-014和Akkermansia显著正相关。
综上所述
A. muciniphila改善了DSS诱导的结肠炎,这可以通过减轻体重减轻、结肠长度缩短和组织病理学评分以及屏障功能增强来证明。因为 A. muciniphila给药,血清和结肠组织中炎症细胞因子和趋化因子(TNF-α、IL1α、IL6、IL12A、MIP-1A、G-CSF和KC)的水平降低。16S rDNA序列分析表明A. muciniphila诱导显著的肠道微生物群改变。此外,相关性分析表明,促炎细胞因子和其他损伤因子与Verrucomicrobia、Akkermansia、Ruminococcaceae和Rikenellaceae呈负相关,它们在A. muciniphila处理的小鼠中显著丰富。总之,该研究证实,A. muciniphila治疗可以通过微生物-宿主相互作用(保护肠道屏障功能并降低炎性细胞因子的水平)或通过改善微生物群落来改善粘膜炎症。A. muciniphila对DSS诱导的小鼠结肠炎发挥保护作用,表明A. muciniphila可能是改善结肠炎的潜在益生菌剂。
研究报告原文详见:

文章仅供学术探讨,如需转载请注明出处。
 yzh@akkpro.com
yzh@akkpro.com


