欢迎您访问爱非克(深圳)生物科技有限公司
随着工业及交通快速发展,外伤事故发生率逐年增加,骨折发生率也增高。虽然治疗骨折的技术和植入材料有所改进,但仍有许多患者出现愈合延迟或骨不连,造成了巨大的医疗和经济成本。

改善血运重建是骨折治疗的主要措施之一,中度局部炎症会触发血管生成,而全身性或额外的局部炎症会抑制血运重建并损害骨折愈合。既往研究表明,一种名为H型的特定血管亚型,其高度表达血小板-内皮细胞粘附分子(CD31)和内粘蛋白(Emcn),可将血管生成和成骨结合起来。
AKK菌是一种肠道益生菌,多项研究表明A. muciniphila具有广泛的生物活性,可通过收紧肠道屏障来改善全身炎症。
在一项对骨折小鼠愈合的影响实验中,用A. muciniphila胃内给药的骨折小鼠比用PBS处理的小鼠表现出更好的骨折愈合,且诱导了更多的血小板源性生长因子BB(PDGF-B)阳性的破骨细胞,与H型血管形成增加相吻合。
此外, 研究使用葡聚糖硫酸钠(DSS)来破坏肠道屏障,结果表明A. muciniphila治疗显著改善DSS处理的肠道屏障,减轻炎症,并恢复小鼠受损的骨骼愈合和血管生成。这些结果都表明A. muciniphila有潜力作为一种很有前途的骨愈合策略。
研究内容
A. muciniphila对骨折愈合的影响实验:C57BL/6雌性小鼠(8周龄)戊巴比妥钠(50mg/kg)腹腔注射全身麻醉后,开切口后使用锋利的剪刀在股骨的中轴上造成横向骨折,确认骨折完全后,缝合伤口。小鼠分为A. muciniphila(ATCC, BAA-835)、L. gasseri (ATCC, 33323)和PBS组,分别给予0.5 ml含8×108 CFUs A. muciniphila或L. gasseri的PBS,或等体积的PBS,每周处理两次,共6周。
ABX处理实验:小鼠分为两组:ABX+PBS和ABX+A. muciniphila。所有小鼠均服用含有万古霉素(0.5 g/l)、氨苄青霉素(1 g/l)、新霉素(1 g/l)和甲硝唑(1 g/l)的广谱抗生素混合物(APX)的饮用水2周,然后是2天的洗脱期。将粪便样品置于培养基进行96小时厌氧培养以确保粪便微生物群耗竭。然后对所有小鼠进行骨折手术。ABX+A. muciniphila组小鼠在手术当天开始口服灌胃0.5 ml含8×108 CFUs A. muciniphila的PBS,ABX+PBS组给小鼠等体积的PBS,每周2次,共6周。
DSS实验:所有小鼠分为3组:PBS组、DSS+PBS组和DSS+A. muciniphila组。骨折手术前对DSS+PBS组和DSS+A. muciniphila组进行为期7天的DSS处理,将2.5%(w/v)DSS随意添加到饮用水中。手术后进行3个周期的治疗(8天正常饮水,6天DSS)直至实验结束。在整个实验过程中,PBS组的小鼠接受正常的饮用水。DSS+A. muciniphila组小鼠每周口服施用0.5 ml含8×108 CFUs A. muciniphila的PBS两次。PBS组和DSS+PBS组中的每只小鼠给予等体积的PBS。所有小鼠每周称重两次直至处死。
各个实验小鼠在1、2、4和6 WPF时全身麻醉处死,眼球摘除术收集全血样本进行分析,收集粪便微生物进行A. muciniphila定量和16S rDNA qRT-PCR分析,采集的骨折股骨进行显微计算机断层扫描(µCT)分析、生物力学测试以及组织学、免疫组织化学和免疫荧光分析。
研究结果
A. muciniphila治疗的小鼠骨折愈合质量提高
提取从粪便微生物样本培养的A. muciniphila DNA进行PCR扩增,琼脂糖凝胶电泳显示PCR产物条带在300 bps和400 bps之间,这与A. muciniphila基因组DNA中正向和反向引物之间的分数体积(329 bps)一致。qRT-PCR分析四个时间点(1、2、4 和 6 WPF)的粪便样本表明,在2、4和6 WPF时添加A. muciniphila显著提高了粪便中的A. muciniphila丰度。这些数据表明A. muciniphila已成功定植于小鼠的肠道。
为比较A. muciniphila组和PBS组之间的骨折愈合质量,通过μCT分析测量愈伤组织中的矿化骨量(BV)、总愈伤组织体积(TV)和BV/TV。结果显示,在1 WPF时A. muciniphila组的TV大于PBS组;在4和6 WPF时A. muciniphila组的BV远高于PBS组。A. muciniphila和PBS组小鼠的TV在2 WPF时达到峰值,然后逐渐下降,可能是由于愈伤组织重塑。A. muciniphila组的BV/TV值在1 WPF时略低,但在4 WPF和6 WPF时显著高于PBS组,这归因于后期A. muciniphila组的BV提升。
组织矿物质密度分析表明,A. muciniphila处理在6 WPF时增强了愈伤组织矿化。接下来在6 WPF时进行四点弯曲测试骨折股骨的生物力学特性,结果显示A. muciniphila组骨折股骨的最大弯曲载荷显著大于PBS组。这些结果表明,与PBS处理相比,补充A. muciniphila的小鼠股骨骨折模型在早期导致更多的愈伤组织形成,并在后期加速矿化。该研究还使用一系列特异性引物进行16S rDNA qRT-PCR分析,以确定A. muciniphila补充剂是否改变肠道微生物组,结果显示A. muciniphila诱导放线菌显著增加,这与前人研究一致。此外,A. muciniphila的定植降低了γ-Proteobacteria的丰度并导致拟杆菌增加。
为确认A . muciniphila的直接效果,使用抗生素混合物(ABX)消耗肠道微生物群后再将小鼠骨折并重新测试A. muciniphila的作用,结果显示,A. muciniphila仍然促进ABX处理小鼠的骨折愈合。BV和TV均在6 WPF时升高,从而提高抗弯曲性能。qRT-PCR分析显示A. muciniphila成功定植于ABX处理小鼠的肠道。这些结果表明A. muciniphila具有通过内源性微生物独立的机制刺激骨折修复的能力。
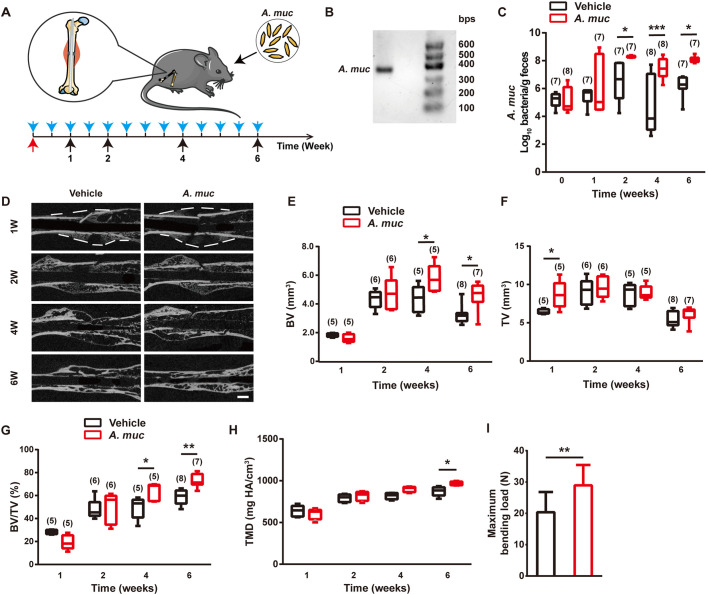
图 A. muciniphila治疗可加速骨折愈合
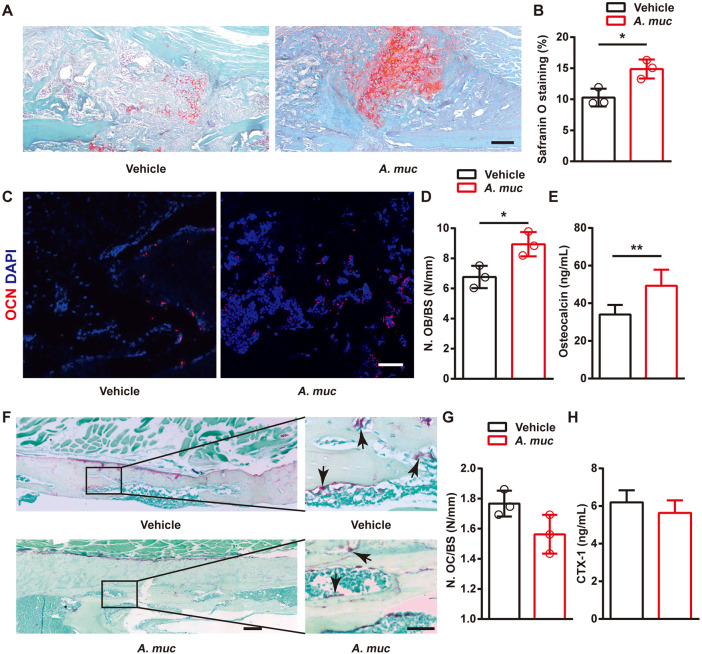
图右 A. muciniphila对股骨骨折小鼠上软骨愈伤组织形成、成骨和破骨细胞形成的影响
A. muciniphila处理改善小鼠的骨形成
接下来研究A. muciniphila治疗是否影响软骨样愈伤组织形成、骨形成和骨吸收。番红O染色显示,在2 WPF时,与PBS处理的小鼠相比,A. muciniphila处理小鼠的骨折愈伤组织中形成了更多的软骨样基质,这被认为有利于后期的骨化。一致地,骨钙素(OCN)的免疫染色显示,与PBS组相比,A. muciniphila组在6 WPF时愈伤组织区有更多的成骨细胞。酶联免疫吸附试验(ELISA)结果表明,通过A. muciniphila处理,OCN(骨形成的血清标志物)的血清水平也显著升高。TRAP染色表明TRAP+多核细胞(破骨细胞)在A. muciniphila和PBS组之间没有统计学显著差异。同时,在6 WPF时可以检测到两组之间血清中Ⅰ型胶原交联C末端肽(CTX-1)没有显著差异。这些数据表明,补充A. muciniphila可改善早期和后期的骨折愈合,更好的骨修复可能归因于骨形成的增加。
A. muciniphila处理刺激愈伤组织中H型血管的形成
H型血管负责支持骨形成,前破骨细胞可以释放PDGF-BB来诱导H型血管的形成,从而减轻性类固醇缺陷小鼠的骨质流失。依据前人研究在2 WPF验证前破骨细胞和破骨细胞的数量,TRAP染色显示,与PBS处理的小鼠相比,2 WPF时A. muciniphila处理的小鼠骨折区域的编织骨表面上的破骨细胞明显更多,而破骨细胞则更少。在2 WFP进行TRAP和PDGF-BB的联合免疫染色,正如预期的那样,检测到A. muciniphila处理的编织骨表面上PDGF-BB阳性的前破骨细胞(TRAP+单核细胞)比PBS处理的小鼠中更多。接下来,为确定H型血管的形成,在2 WPF时对CD31和Emcn进行联合免疫染色,数据显示,与PBS处理的小鼠相比,A. muciniphila处理的小鼠骨折区域的总血管和H型血管的形成显著更高,而非H型血管的形成在两组之间相似。总之,A. muciniphila治疗有效地促进愈伤组织中H型血管的形成,这可能归因于骨折区域中PDGF-BB+前破骨细胞数量的增加。

图 补充A. muciniphila刺激小鼠股骨骨折中的前破骨细胞和H型血管形成
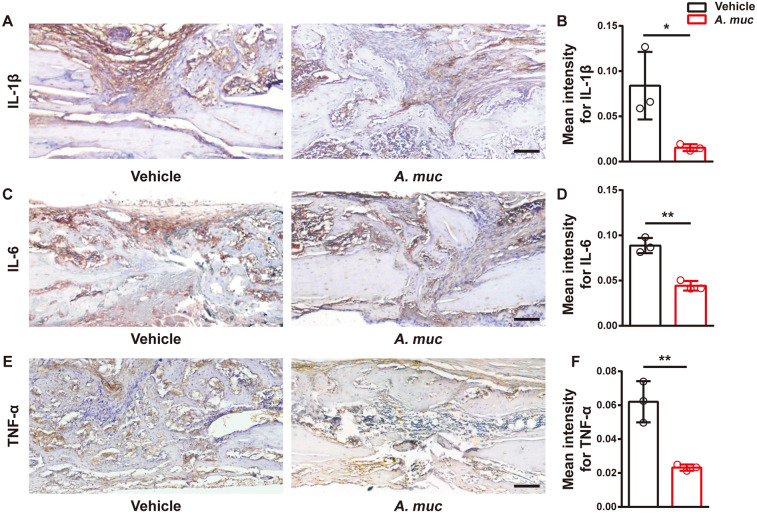
图 A. muciniphila治疗减轻小鼠股骨骨折的局部炎症反应
补充A. muciniphila的小鼠在骨折愈合的早期阶段表现出较低水平的炎症反应
过度炎症被认为是骨折愈合过程中抑制血管形成的最重要的全身因素之一。鉴于A. muciniphila在体内的抗炎作用,该研究在2 WPF时测量了骨折部位的局部炎症水平。免疫组织化学分析显示,A. muciniphila组骨折区域中白细胞介素1β (IL1β)、IL6和肿瘤坏死因子-α(TNF-α)的染色强度比PBS组弱。值得注意的是,所有这些促炎细胞因子以前都被证明会损害骨折愈合中的血管生成。
前破骨细胞生存、增殖和破骨细胞分化需要巨噬细胞集落刺激因子(M-CSF),而核因子κ B受体活化因子配体(RANKL)是另一种关键的破骨细胞生成细胞因子。评估血清中M-CSF和RANKL的水平发现,这两个因子在2 WPF时都被A. muciniphila显著下调,此时A. muciniphila对骨折部位产生抗炎作用。该结果与之前的多项研究一致,炎症可以刺激M-CSF和RANKL的产生,在没有M-CSF的情况下,单独的RANKL不能诱导破骨细胞生成。这些数据综合表明,A. muciniphila治疗的抗炎结果可能是更多数量的前破骨细胞和H型血管以及加速骨折愈合的原因。
A. muciniphila治疗会降低肠道通透性和炎症
由于骨折被证明会增加肠道通透性,该研究分析了一类紧密连接蛋白的肠道mRNA 表达,包括occludin、jam3、claudin2、claudin3和claudin 15。数据显示在2 WPF时这些因子的肠道mRNA水平在A. muciniphila处理的小鼠中显著高于PBS处理的小鼠。为进一步证实A. muciniphila诱导的肠道屏障改善,这两组的小鼠在2和6 WPF时口服异硫氰酸荧光素-葡聚糖(FITC-葡聚糖),4小时后测试FITC-葡聚糖的血清浓度,结果显示,PBS处理的小鼠在2 WPF时具有更高的FITC-葡聚糖血清水平,而在6 WPF时两组之间的差异不显著。鲎变形细胞裂解物(LAL)测定表明,与2 WPF而非6 WPF时的PBS处理相比,A. muciniphila处理导致循环LPS降低。相应地,与PBS处理的小鼠相比,在2 WPF时A. muciniphila处理小鼠的肠道促炎因子TNF-α和IL17a的mRNA水平显著降低,但肠道抗炎因子IL10的mRNA水平显著升高。在6 WPF时A. muciniphila处理的肠道屏障收紧作用和肠道抗炎作用不如在2 WPF时强。为测试A. muciniphila对全身炎症的影响,通过ELISA测试血清样品,结果表明,在早期阶段,A. muciniphila升高抗炎因子IL10的水平并降低TNF-α和血清淀粉样蛋白A3(SAA3)的水平,这两个被认为会促进炎症和刺激破骨细胞生成。综上所述,A. muciniphila治疗在早期降低了肠道通透性和全身炎症,此时骨折区域的血管生成达到最高水平。
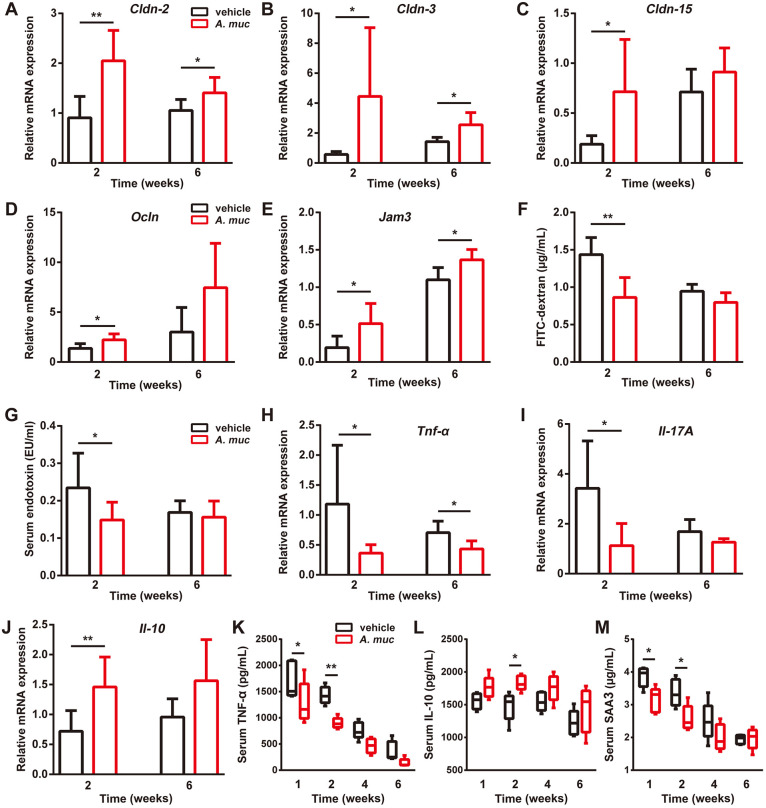
图 A. muciniphila给药可收紧肠道屏障并减少股骨骨折小鼠模型中的全身炎症
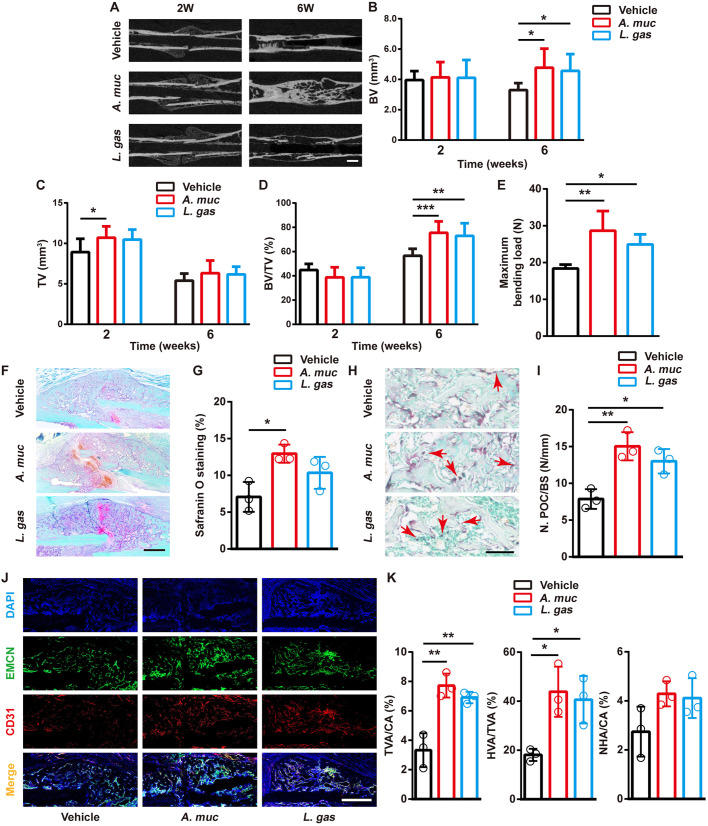
图 补充益生菌可促进骨骼修复和血管生成
补充益生菌促进骨折愈合
该研究重新评估了A. muciniphila对骨折愈合的影响,并增加一个L. gasseri治疗对照组,来研究改善的骨折愈合是否是A. muciniphila所特有的,以及其他降低肠道通透性和炎症的益生菌是否也可以促进骨骼修复。µCT扫描显示,用L. gasseri治疗的小鼠与PBS处理的小鼠相比,在2 WPF时表现出更高的BV和在6 WPF时更高的TV。生物力学测试还表明,L. gasseri治疗小鼠的股骨比PBS处理小鼠的股骨具有更好的愈合质量。番红O染色显示在2 WPF时L. gasseri处理的骨折愈伤组织软骨基质形成略有增加。该研究还发现在2 WPF时L. gasseri处理导致愈伤组织中产生更多的前破骨细胞。与A. muciniphila相似,L. gasseri处理也促进新血管的形成,尤其是H型血管。这些结果表明L. gasseri治疗也具有改善骨折愈合的能力。
A. muciniphila治疗挽救肠道屏障功能障碍引起的骨愈合障碍
为了解肠道屏障在骨折修复中的作用以及当肠道通透性增加时A. muciniphila是否仍然有效,使用DSS来破坏肠道屏障。DSS实验显示,所有接受DSS处理的小鼠在早期都表现出明显较低的体重。然而,到第35天,DSS+A. muciniphila组的小鼠开始表现出比DSS+PBS组更高的体重。在实验后期,DSS+A. muciniphila组的小鼠体重与PBS组相似。DSS处理显著缩短了结肠,而A. muciniphila治疗显著减轻肠道损伤。结肠切片的苏木精伊红(HE)染色显示,A. muciniphila在2 WPF和6 WPF时明显挽救了DSS诱导的粘膜损伤和肠道炎症。
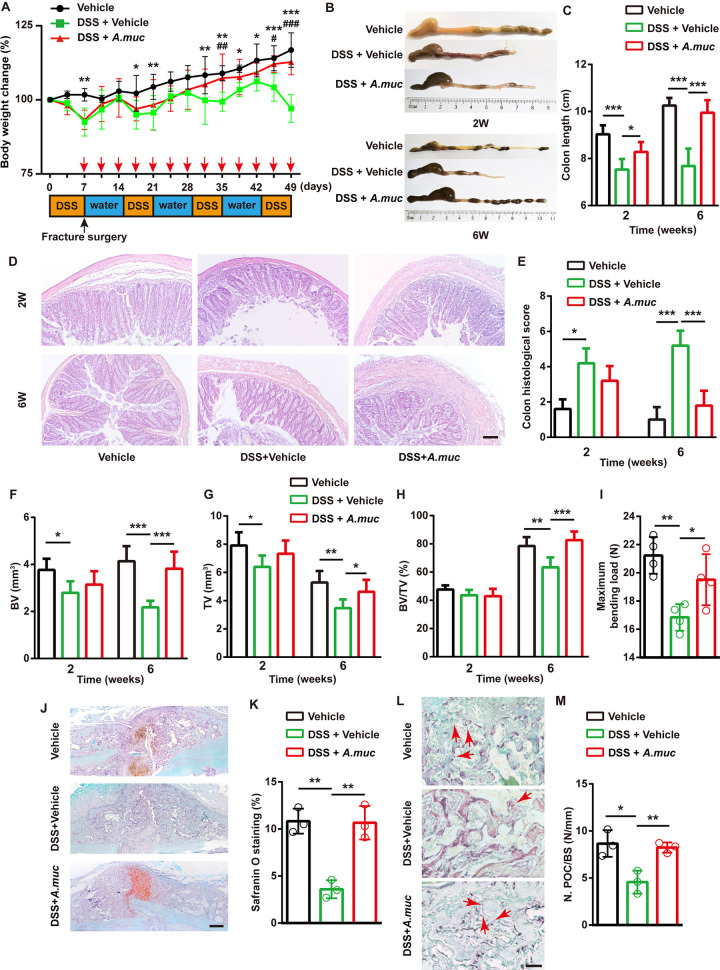
图 A. muciniphila保护免受DSS诱导的骨折愈合损伤
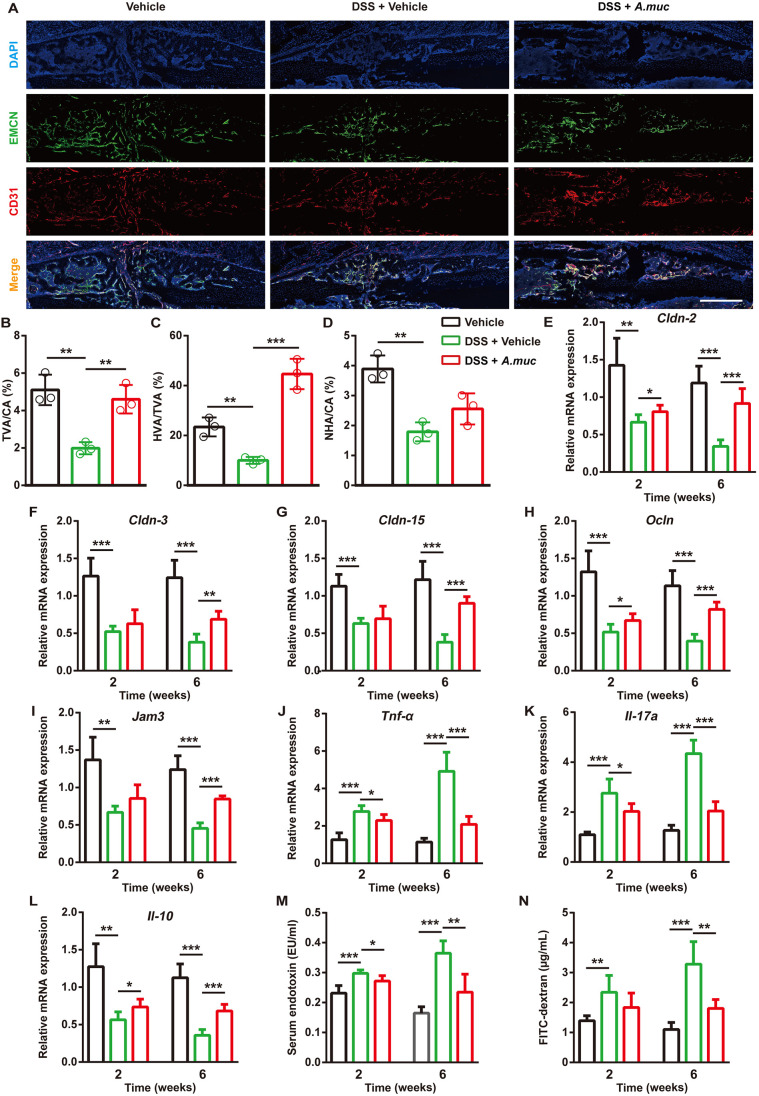
图 A. muciniphila治疗恢复H型血管形成并降低DSS治疗小鼠的肠道通透性
µCT结果显示在2和6 WPF下DSS+PBS组BV和TV减少,表明DSS阻碍骨愈合。DSS+A. muciniphila组小鼠的BV和TV比DSS+PBS组小鼠高得多,甚至在6 WPF时比PBS组小鼠的BV/TV略高。四点弯曲试验表明A. muciniphila显著增强DSS处理小鼠的生物力学特性。此外,番红O和TRAP染色证明A. muciniphila处理恢复了软骨样基质的形成和前破骨细胞的数量。测试三组的血管生成显示,DSS处理显著减少新血管的形成,包括H型和非H型血管。A. muciniphila治疗减弱DSS引起的血管生成损失,主要是H型血管。接下来测试一类肠道屏障和炎症相关的mRNA表明,A. muciniphila治疗收紧了受损的肠道屏障完整性并减少DSS处理小鼠的结肠炎症。一致地,血清LPS和血清FITC-葡聚糖水平也表明A. muciniphila治疗降低了肠道通透性。这些证据表明,A. muciniphila治疗可以通过收紧肠道屏障和减少炎症来促进骨骼修复和 H 型血管的形成。
研究结论
在该研究中,用A. muciniphila胃内给药的骨折小鼠比用PBS处理的小鼠表现出更好的骨折愈合。值得注意的是,A. muciniphila在骨折后2周诱导了更多的血小板源性生长因子BB(PDGF-B)阳性的破骨细胞,与H型血管形成增加相吻合。此外,A. muciniphila治疗在早期显著降低肠道通透性和炎症。硫酸葡聚糖钠(DSS)破坏肠道屏障后,A. muciniphila治疗明显改善DSS处理的肠道屏障,减少了炎症,并恢复小鼠受损的骨骼愈合和血管生成。这些结果表明A. muciniphila降低肠道通透性并减轻炎症,这可能会在愈伤组织中诱导更多的 PDGF-BB+前破骨细胞和H型血管形成,从而促进骨折愈合。该研究为H型血管参与骨折愈合提供了证据,并表明A. muciniphila有潜力作为一种很有前途的骨愈合策略。
研究报告原文详见:

 yzh@akkpro.com
yzh@akkpro.com


