欢迎您访问爱非克(深圳)生物科技有限公司
关键词;AKK菌
随着人们的生活水平越来越高,许多人日益肥胖,肥胖是多种慢性疾病的基础,尤其与糖尿病的发生密切相关,糖尿病已经成为威胁人类健康的全球流行性疾病。
其中,Ⅱ型糖尿病(T2D)是一种具有不同表现和并发症风险的复杂疾病。虽然肥胖和超重是Ⅱ型糖尿病发展的主要诱因 ,但也有一部分患者体型偏瘦或体重正常。与肥胖型T2D患者相比,瘦型T2D患者具有不同的临床特征和糖尿病并发症的风险。

越来越多科研人员对T2D潜在因素的研究集中在肠道微生物组上,与不患有T2D的人相比,T2D患者的宏基因组往往在组成和功能上都有区别。然而,肠道微生物群的改变是否以及如何在功能上影响瘦型和肥胖型T2D之间的不同临床特征仍然不清楚。
该研究对182名健康和新诊断的T2D的瘦弱和腹部肥胖个体进行宏基因组学和靶向代谢组学分析,发现AKK菌丰度在瘦型T2D患者中显著降低,其丰度与血清3β-鹅去氧胆酸(β CDCA)水平呈负相关,与胰岛素分泌和成纤维细胞生长因子15/19(FGF15/19) 浓度呈正相关。补充AKK菌可以保护小鼠免受高蔗糖饮食引起的葡萄糖耐受不良。
另外,该研究进一步发现,AKK菌丰度减少与瘦型T2D患者中胰岛素分泌和葡萄糖稳态的损害有关,可通过补充AKK菌改善葡萄糖耐量,这表明AKK菌或许可为预防和治疗糖尿病提供新方向。
研究内容
临床实验
从2014年5月至2014年6月,选择四组182名性别匹配的成年个体参与者,包括正常葡萄糖耐量-瘦组(NGT-NO,n = 52)、正常葡萄糖耐量-腹部肥胖组(NGT-O,n = 52)、新诊断T2D-瘦组(T2D-NO,n = 22)、新诊断T2D-腹部肥胖组(T2D-O,n = 56)。对所有参与者进行了口服葡萄糖耐量试验(OGTT),所有参与者都接受了全面的身体检查,包括常规生化血液分析和心电图。通过统一的问卷调查获得有关人口统计学、吸烟习惯、饮酒量、教育水平、疾病家族史、手术史以及当前和过去药物治疗的信息。收集参与者的粪便,提取DNA在Illumina HiSeq 4000平台上进行鸟枪宏基因组测序,每个样本(总n = 182)的平均测序通量约为3160万次读取,经过质量控制和过滤后,每个样本平均保留3120万个读数,用于下游分类分析以及从头组装、基因预测、功能注释和分析。另外通过靶向代谢组学定量分析血清BA和支链氨基酸(BCAA)水平。
动物实验
八周大的C57BL/6J小鼠被饲养在特定的无病原体、单独通风的笼子里,每笼5只小鼠。随意给予水。实验小鼠分为四组:喂食正常食物(CK)、高蔗糖(HS)饮食(含42%蔗糖[g%])和活Akkermansia muciniphila(A. muciniphila)(HS-AKK)、高蔗糖饮食和热灭活A. muciniphila(HS-hk AKK)或者高蔗糖饮食和饮用水(HS-water),持续处理15周,每天更换饮用水。每7天测量一次体重。HS-AKK组口服2 mL含5 × 1010 CFUs/mL活A. muciniphila菌(目录号22959,模式菌株,德国微生物菌种保藏中心DSMZ)的含有20%甘油的厌氧无菌PBS。对于HS-hk AKK组,A. muciniphila在121 °C和225 kPa压力下加热杀死15分钟。15周后收集各组小鼠粪便分析微生物水平。小鼠禁食进行体内葡萄糖耐受试验(GTT)、胰岛素耐受试验(ITT)和葡萄糖刺激的胰岛素分泌(GSIS)。收集小鼠胰腺样品分离胰岛进行体外测定胰岛素分泌。
体外细胞实验
小鼠胰腺β细胞系MIN6用于研究3β-鹅去氧胆酸(β CDCA)对胰岛素分泌的影响。细胞在存在或缺少0.5 µmol/L β CDCA的情况下,用2.8、8.3和15 mmol/L葡萄糖刺激MIN6细胞1小时。
人体肠道细胞系LS174T用于研究β CDCA对FGF19表达的影响。在150 μmol/L CDCA的存在下,用50、100和200 μmol/L β CDCA刺激LS174T细胞24小时。
研究结果
参与者特征
所有参与者中,在T2D-NO组和NGT-NO组之间未观察到体重指数(BMI)、腰围、大腿围、内脏脂肪面积(VFA)和皮下脂肪面积(SFA)的显著差异。T2D-NO组和T2D-O组之间的空腹血糖(FPG)、口服葡萄糖耐量试验(OGTT)期间的2 h血糖(2hPG)和HbA1c没有显著差异。在四组中,T2D-NO组参与者的胰岛素分泌(HOMA-% B)、第一阶段胰岛素释放(1st PH)和第二阶段胰岛素释放(2nd PH)的稳态模型评估最低,表明胰岛素分泌功能障碍。还发现T2D-NO和T2D-O组参与者的空腹成纤维细胞生长因子19(FGF19)水平显著低于NGT-NO组。四组在文化程度、饮酒量和吸烟习惯等方面均无显著差异。
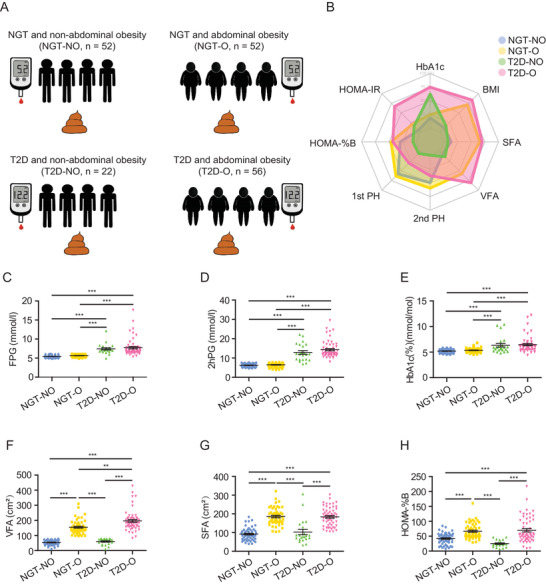
图 四组的总体研究设计和主要临床数据
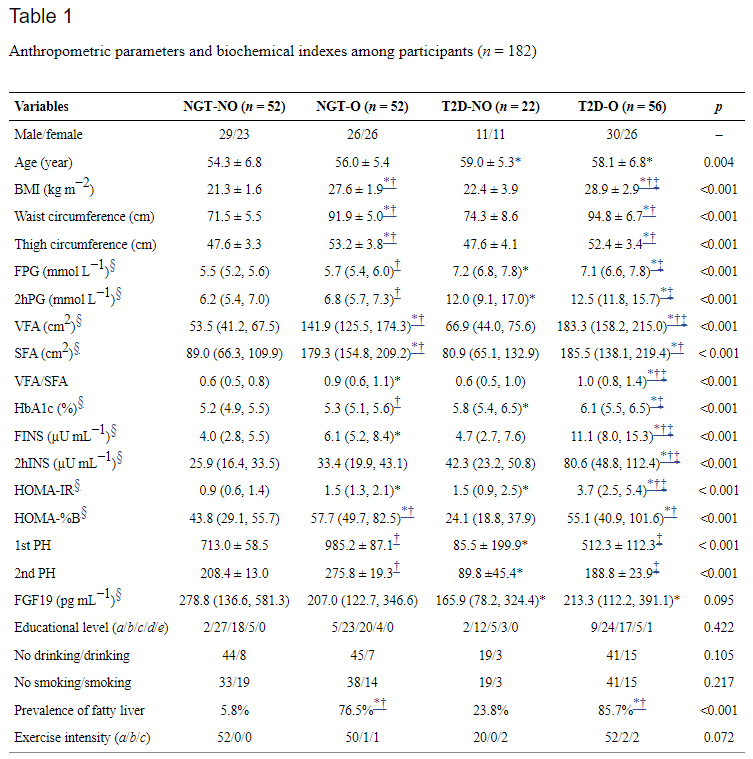
图 参与者的人体测量参数和生化指标表
四组中不同的肠道微生物组成
对所有182名参与者的粪便样本进行鸟枪宏基因组测序分析发现,在健康和新诊断T2D人群以及瘦或腹部肥胖人群中,Bacteroides、Firmicutes和Proteobacteria门是所有组中最主要的门,这些门占肠道微生物组成的96%以上,其他细菌的丰度要低得多(平均低4%)。与其他三组相比,T2D-NO组Firmicutes门的相对丰度(30%)平均较高,Bacteroidetes门的相对丰度(62%)平均较低。然而,四组之间在门水平上没有观察到显著差异。
分类分析后计算并比较四组间群落水平的微生物群多样性,结果发现,T2D-NO组比T2D-O组具有更高的α多样性。虽然基于系统发育的未加权UniFrac距离的主坐标分析(PCoA)显示四组之间没有明显的分离,但在计算β多样性时,通过加权UniFrac距离考虑物种丰度,可以捕获T2D-NO组的不同微生物组成。这一发现表明,尽管所有四组的细菌集高度相似,但与其他三组相比,T2D-NO组的丰度分布可能是独一无二的。更具体地说,T2D-NO和T2D-O组以及T2D-NO和NGT-O组之间存在显著差异。尽管 NGT-NO和T2D-NO组之间存在分离趋势,但在群落水平上没有发现显著差异。有趣的是,我们从PCoA中发现NGT-O和T2D-O组具有高度相似的整体肠道微生物群落特征。
根据微生物β多样性确定T2D-NO vs NGT-O和T2D‐NO vs T2D‐O组之间的显著差异后,研究发现27个菌种在两个比较中存在显著差异,两个比较之间有几个共同的菌种。尽管T2D-NO和NGT-NO对照组没有表现出显著的群落水平差异,但发现两组之间的个体物种存在差异,如A. muciniphila、Parprevotella xylaniphila、Ruminococcaceae bacterium d16和Prevotella copri,表明T2D-NO 和NGT-NO组的差异在于某些微生物,而不是整个群落的大变化。
然后,该研究通过构建微生物共丰度网络研究四种不同代谢条件下的物种相互作用。虽然T2D-NO组网络的大小似乎与NGT-NO组网络相似,但它没有很好地连接,在Faecalibacterium prausnitzii和Bacteroides stercoris之间只有一个关键的“桥梁”相互作用。为支持该猜想确定了几个常用的网络拓扑属性,例如平均最短路径长度、接近中心性和聚类系数。T2D-NO组的亲近中心性显著低于NGT-NO组。与其他三组相比,T2D-O组的细菌共丰度网络非常小且信息量不足。NGT-O网络比NGT-NO对照组更小、更简单,但比T2D-O组更复杂。
微生物组的功能表征
接下来进行京都基因和基因组百科全书(KEGG)功能模块比较发现,这四组表现出显著的发散模块富集。例如,T2D患者(T2D-NO和T2D-O组)的肠道微生物群显示出“泛酸和CoA生物合成”、“黄酮和黄酮醇生物合成”、“氨基糖和核苷酸糖代谢”和“酪氨酸代谢”的富集。腹部肥胖患者(NGT-O和T2D-O组)的肠道微生物群显示“泛醌和其他萜类-醌生物合成”和“托烷、哌啶和吡啶生物碱生物合成”的富集。然后,研究T2D-NO和NGT-NO组之间的差异微生物功能发现,T2D-NO组个体参与各种碳水化合物的摄取和磷酸化的磷酸转移酶系统的功能潜力耗尽。T2D-NO微生物组中增加“缬氨酸、异亮氨酸生物合成”功能模块。在三种支链氨基酸(BCAA)中,T2D-NO受试者的循环缬氨酸显著高于NGT-NO受试者。亮氨酸和异亮氨酸水平在T2D-NO受试者中也有高于NGT-NO受试者。这些数据表明,T2D-NO个体的微生物群可能具有较低的碳水化合物利用能力和较高的BCAA生产能力。此外,与 NGT-NO微生物组相比,T2D-NO中参与碳水化合物代谢(包括“半乳糖降解”)的KEGG模块高度富集。
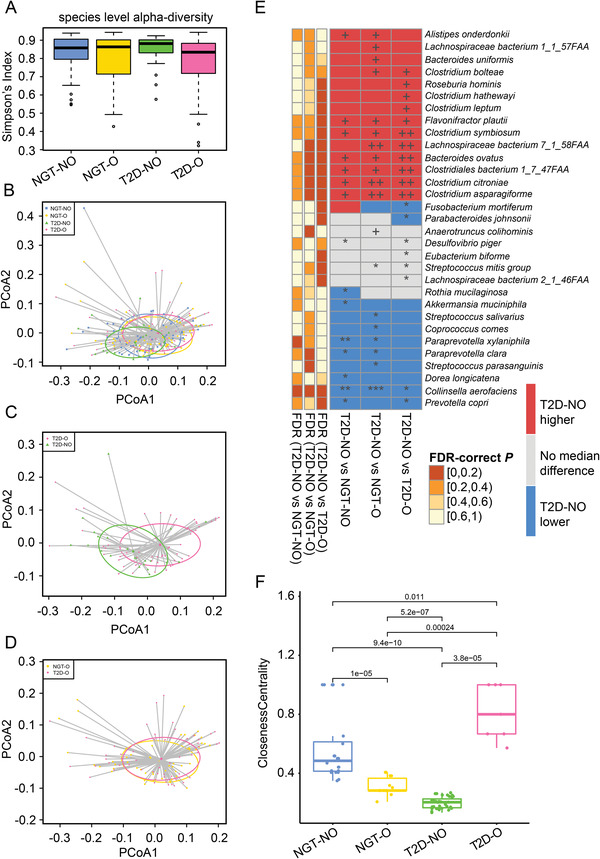
图 微生物群落多样性和组成的比较
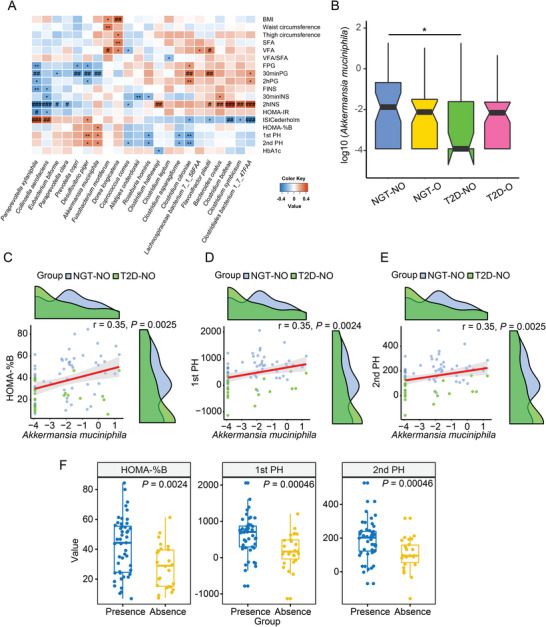
图 A. muciniphila与胰岛素分泌呈正相关
A. muciniphila丰度在T2D-NO中减少并与胰岛素分泌呈正相关
四组参与者在体重相关指标、胰岛素敏感性和胰岛素分泌方面具有不同的临床特征。在调整年龄之前和调整后,观察到肠道微生物种类与体重相关指标和葡萄糖代谢之间的密切关系。益生菌A. muciniphila在T2D-NO组中显著低于NGT-NO组,但在T2D-O和NGT-O组之间没有显著差异。此外,A. muciniphila与此处测量的所有胰岛素分泌相关指标(HOMA-%B、1st PH、2nd PH)呈正相关,在调整年龄后仍然显著。此外,出现A. muciniphila的样本中的三种胰岛素分泌量显著高于缺少A. muciniphila的样本,进一步支持了肠道中A. muciniphila与胰岛素分泌之间的潜在关联,在其他组的相关分析中未观察到A. muciniphila和胰岛素分泌之间的这种正相关,也未发现A. muciniphila与胰岛素敏感性之间存在显著关联。
血浆BAs与临床参数和A. muciniphila 的关系
为研究BA是否参与A. muciniphila影响胰岛素分泌的过程,选择每组性别和年龄相匹配的20名参与者,作为血清BA靶向代谢组学分析的亚组。亚组和总队列的主要临床特征如VFA、SFA、FPG和2hPG之间没有发现显著差异。在37个鉴定的血清BA中,四组中共有20个有显著不同。这20个中确定为T2D-NO和NGT-NO组之间的5个不同级别的BAs:甘氨熊去氧胆酸、3β-鹅去氧胆酸(β CDCA)、β-熊胆酸、3β-胆酸和尿刊酸。
然后,研究确定NGT-NO和T2D-NO组的临床参数、BA和肠道微生物组之间的Spearman's相关性,结果发现,β CDCA与A. muciniphila的相对丰度和胰岛素分泌指数1st PH和2nd PH呈负相关。进一步将宏基因组功能纳入相关分析,以探索A. muciniphila如何影响BA代谢。值得注意的是,胆汁酸-辅酶A连接酶(BA诱导的操纵子,baiB)(KEGG Ortholog K15868)的一个关键基因的宏基因组丰度与A. muciniphila丰度呈正相关,并且在T2D-NO中低于NGT-NO组。baiB参与将初级BA鹅去氧胆酸(CDCA)转化为鹅去氧胆酰辅酶A,后者进一步用于下游次级BA生物合成。此外,baiB丰度与β CDCA负相关,次级BA生物合成途径中的替代CDCA使用途径的产物(KEGG ko00121)。综上所述,T2D-NO组A. muciniphila和baiB的丰度较低,胰岛素分泌减少,β CDCA较高,说明CDCA转化为β CDCA 的次数更多,表明A. muciniphila和胰岛素分泌之间的联系可能受β CDCA水平介导。
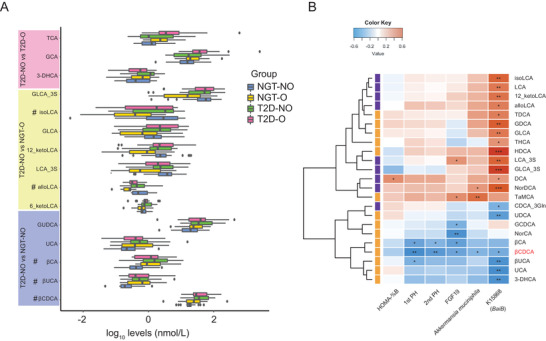
图 A. muciniphila与FGF19和胆汁酸之间的关系
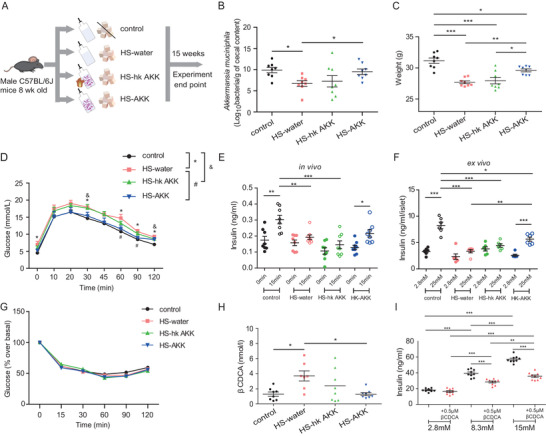
图 A. muciniphila宿主新陈代谢的影响
A. muciniphila对胰岛素分泌的影响
上述分析表明,与NGT-NO患者相比,T2D瘦的参与者的A. muciniphila的相对丰度较低,并且根据HOMA-% B、1st PH和2nd PH的评估,A. muciniphila的丰度与胰岛素分泌呈正相关。在此基础上,该研究使用高蔗糖(HS)饮食来模拟小鼠的T2D-NO,进而检查A. muciniphila对宿主代谢的可能影响。RT-PCR显示,与喂食正常食物的小鼠相比,喂食HS饮食的小鼠粪便中的A. muciniphila数量显著减少,用 5 × 1010 CFU/mL活A. muciniphila处理15周足以恢复因HS饮食而降低的水平。15周后,喂食HS饮食的小鼠(HS-water组)体重低于对照组,同时,HS饮食还导致葡萄糖耐量受损和葡萄糖刺激后胰岛素分泌减弱。HS-AKK组小鼠体重明显高于HS-water组小鼠,然而,HS-hk AKK组未发现体重增加。用活菌而不是热灭活的A. muciniphila处理显著改善了葡萄糖耐量。此外,研究A. muciniphila对体内和体外胰岛素分泌的影响发现,在体内,四组之间未观察到空腹胰岛素分泌的显著差异,A. muciniphila干预后葡萄糖刺激的胰岛素分泌恢复,然而,HS-hk AKK组胰岛素分泌没有改善。在离体实验中,与对照组中的2.8 mmol/L相比,25 mmol/L的葡萄糖浓度导致胰岛素释放显著增加,而从HS-water组分离的胰岛显示胰岛素释放受损。与体内发现一致,HS-AKK组分离的胰岛显示出葡萄糖刺激的胰岛素分泌改善,而HS-hk AKK组分离的胰岛不存在这种情况。四组间胰岛素敏感性无显著差异。这些结果表明,胰岛素分泌明显受损但没有胰岛素抵抗的小鼠模型表现出A. muciniphila数量减少,补充活的A. muciniphila可恢复胰岛素分泌并改善葡萄糖耐量。
A. muciniphila治疗减少β CDCA水平,并刺激胰岛素分泌
使用小鼠进一步研究A. muciniphila对血清BA的影响,结果发现,27 BAs的代谢组学谱分析表明四个小鼠组间的5个BAs(猪胆酸、α-猪去氧胆酸、ω-鼠胆酸、石胆酸和β CDCA)水平存在显著差异。与对照组相比,HS-water组的循环β CDCA水平显著更高,并且用活的A. muciniphila治疗显著降低β CDCA水平。然而,给予热灭活的A. muciniphila并没有导致β CDCA 水平显著降低。这些结果与观察到的A. muciniphila丰度和βCDCA水平之间的呈负相关一致。
正如发现β CDCA和胰岛素分泌呈负相关,进一步研究β CDCA对胰岛素分泌的可能作用。用葡萄糖刺激小鼠胰腺β细胞系MIN6细胞导致胰岛素水平的显著诱导。葡萄糖和β CDCA一起处理MIN6细胞抑制葡萄糖诱导的胰岛素分泌。上述结果表明A. muciniphila可能通过降低肠道β CDCA水平刺激胰岛素。
A. muciniphila通过抑制β CDCA增强FGF15/19
FGF19可通过不依赖胰岛素的途径刺激糖原合成并抑制糖异生。临床分析表明,与NGT-NO 组相比,T2D-NO组的血清FGF19水平显著降低。此外,FGF19的水平与肠道菌群中A. muciniphila的丰度呈正相关,与β CDCA水平负相关。测量A. muciniphila治疗的小鼠回肠中FGF15的表达发现,与正常饲料喂养的小鼠相比,HS饮食喂养的小鼠的FGF15 mRNA水平显著降低。用活的A. muciniphila治疗恢复了由HS饮食引起的FGF15水平降低。此外,HS饮食显著降低了肝糖原含量,但在用活A. muciniphila治疗后增加。通过RT-PCR分析相关基因表达水平可以确定,补充A. muciniphila 能减弱由HS饮食增加的糖异生作用。
为进一步研究β CDCA是否能抑制FGF15/19的表达,在CDCA存在情况下将人上皮结肠细胞系LS174T与各种浓度的β CDCA一起培养,结果发现CDCA和β CDCA一起处理LS174T细胞造成FGF19 mRNA的表达水平剂量依赖性减少,表明β CDCA抑制肠道FGF15/19的表达。这些结果表明,A. muciniphila可能会,至少部分地通过限制β CDCA的可用性来增强FGF15/19的表达,并引起糖原合成的刺激和糖异生的抑制。
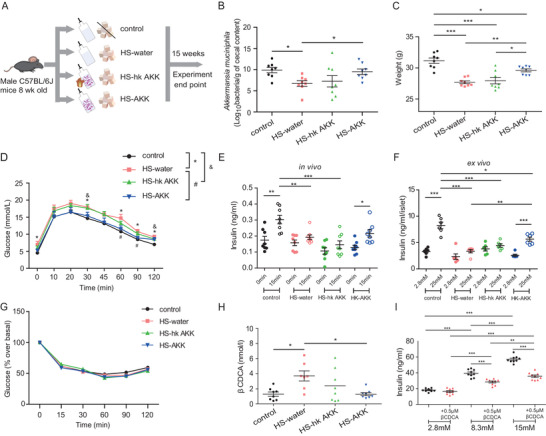
图 A. muciniphila对FGF15/19的表达的影响
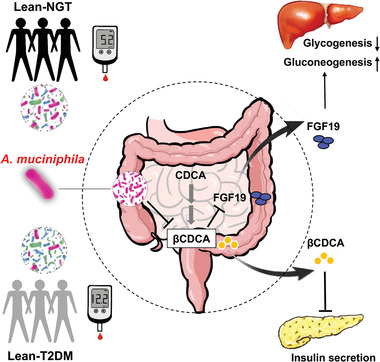
图 A. muciniphila通过改善胰岛素分泌和FGF19表达对葡萄糖代谢的拟议作用机制
研究结论
该研究对182名健康和新诊断的T2D的瘦弱和腹部肥胖个体进行宏基因组学和靶向代谢组学分析,发现A. muciniphila的丰度在患有T2D的瘦个体中显著降低,它的丰度与血清3β-鹅去氧胆酸(β CDCA)水平呈负相关,与胰岛素分泌和成纤维细胞生长因子15/19(FGF15/19) 浓度呈正相关。补充A. muciniphila可以保护小鼠免受高蔗糖饮食引起的葡萄糖耐受不良。进一步研究A. muciniphila对宿主代谢有益影响背后的机制表明,A. muciniphila降低了β CDCA水平,从而增加胰岛素分泌和FGF15/19的表达,导致血糖水平降低和葡萄糖稳态改善。此外,β CDCA 抑制胰岛素分泌和 FGF15/19表达。总之,这些发现表明,A. muciniphila丰度的减少与瘦型T2D中胰岛素分泌和葡萄糖稳态的损害有关,可通过A. muciniphila改善葡萄糖耐量,为预防或治疗糖尿病的新治疗选择铺平了道路。
研究报告原文详见:

文章仅供学术探讨,如需转载请注明出处。
 yzh@akkpro.com
yzh@akkpro.com


