欢迎您访问爱非克(深圳)生物科技有限公司
WHO公布的《2017年全球肝炎报告》显示,全球约3.25亿人感染慢性乙肝病毒或丙肝病毒。其中,2.57亿感染乙肝病毒,7100万感染丙肝病毒。绝大多数病毒感染者无法治愈,数百万人面临发展为慢性肝病、癌症和死亡的风险。
慢性肝病(CLD)是指肝组织逐渐破坏和再生导致的肝功能障碍,可导致高死亡率的纤维化和肝癌。纤维化是一种伤口愈合过程,它在暴露于慢性刺激和持续炎症后激活肝星状细胞(HSC),这导致细胞外基质(ECM)和富含胶原蛋白的组织的过度表达,该组织取代了肝脏的天然实质。
近年来,AKK菌被认为是治疗肥胖相关疾病的新生代益生菌,能通过影响免疫和代谢途径并增加肠道屏障完整性,有助于改善代谢。这些积极效应是通过AKK菌衍生的外膜蛋白(OMP)、代谢物和配体与肠道微生物群落其他成员的直接相互作用而发生的。此外,AKK菌衍生的细菌细胞外囊泡(EVs)似乎也能通过穿透大肠并扩散到肌肉、脂肪和肝组织等来改善高脂肪饮食(HFD)诱导的糖尿病的肠道屏障完整性。肠道微生物群与宿主完全协同并发挥显著作用,例如调节免疫系统、防止病原体定植、改善消化过程和体内营养物质的吸收。因此,保持健康的肠道环境可以保证肝脏健康。
该研究对七个先前收集的四氯化碳(CCl4)诱导肝损伤的微阵列数据集进行荟萃分析,以确定纤维化相关基因,并通过体外细胞实验检测HSCs在活和巴氏杀菌及其EVs给药静止期或经LPS活化的LX-2细胞系的响应,以确定EVs是否能像热灭活的AKK菌一样可以减少类似纤维化相关基因的表达。接下来,通过动物实验来研究活的和巴氏杀菌的AKK菌及其EVs对HFD/CCl4诱导的肝损伤的保护作用。
研究结果显示,口服活的和巴氏杀菌的AKK菌及其EVs可以使粪便靶向细菌组成正常化,改善肠道通透性,调节炎症反应,有效预防HFD/CCl4导致的小鼠肝损伤。
研究内容
肝纤维化的独立微阵列数据集荟萃分析:从国家生物技术信息中心的基因表达综合(GEO)数据库下载的七个公开可用的微阵列数据集,纳入标准如下:(a)CCl4诱导的肝损伤实验研究;(b)实验设置的小鼠肝脏样本;(c)每组的多个样本,HC和CCl4组,高于一个,以及(d)调查所有选定基因表达的研究。利用 R(3.6.1版)统计计算环境进行分析。
细胞实验:人肝星状细胞系LX-2细胞通过使用0.01 μg/ml 大肠杆菌0111:B4的脂多糖(LPS)培养6 h进行激活。之后,未受刺激的LX-2和LPS激活的LX-2细胞在不同的感染复数(MOI 1、10和100)和不同浓度的 EV(1、10、50 μg/ml)处理下培养24小时。LPS激活的LX-2细胞和未经处理的细胞作为对照组。结束后进行细胞活力测定,提取总RNA进行qRT-PCR分析。
动物实验:7-8周龄的雄性野生型C57BL/6小鼠用CCl4伴随高脂肪饮食(HFD)诱导肝损伤,HFD饮食小鼠每周两次腹膜内注射2 ml/kg体重的10% CCl4橄榄油溶液,持续4周。小鼠随机分为五组(n =5):健康对照接受ND、Am (109 CFU/200 μl活A. muciniphila ATCC BAA-835)、Pam(109 CFU/200 μl巴氏杀菌A. muciniphila)、EVs(50 μg 蛋白质/200 μl)和PBS(200 μl无菌PBS)通过每日口服管饲给药4周。在实验开始时、每周更换笼子期间和结束时间点测量体重来测量实验期间的食物摄入量。处死异氟醚麻醉的小鼠时通过球后穿刺采集血液样品用于生化分析。治疗结束后,颈椎脱臼处死小鼠,收集肝、结肠、脂肪、肾组织用于进一步分析。收集粪便样品进行目标微生物群分析。
研究结果
CCL4诱导的肝损伤小鼠模型中的纤维化标志物
对数据集进行的荟萃分析比较CCL4诱导的肝损伤小鼠与对照组的mRNA水平,结果显示8个基因的表达,包括肿瘤坏死因子α (TNF-α)、TLR-2、TLR-4、转化生长因子β(TGF-β)、α平滑肌肌动蛋白(α-SMA)、血小板衍生生长因子(PDGF)、金属蛋白酶组织抑制因子(TIMP1)和肝脏中的1型胶原α1 (Col1a1) 与纤维化密切相关并差异表达。CCL4诱导的小鼠肝纤维化水平高于健康对照组,炎症介质显著表达。此外,与健康对照(HC)小鼠相比,纤维化组中参与组织纤维化和炎症的ECM调节基因(TGF-β、α-SMA、PDGF、TIMP1和Col1a1)显著过表达。对七个数据集的所有25个纤维化和25个对照(HC)样本之间的选定基因进行主成分分析(PCA)表明,对照组(蓝色)是与纤维化组(浅红色)完全分离的簇。由于这些基因在所有数据集中显示出相似且显著的趋势,并且在肝纤维化中也起着关键作用,因此选择该基因用于研究不同形式的A. muciniphila对纤维化相关标志物的影响。结果表明,与健康对照组相比,所有八个基因在纤维化组之间均显著差异表达。
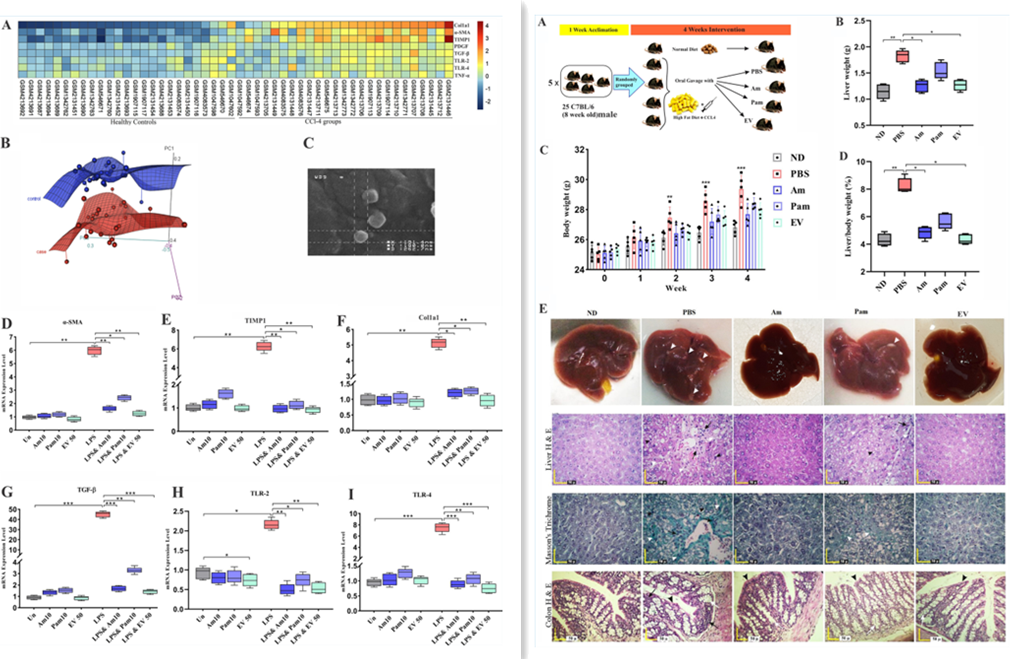
图左 微阵列数据集荟萃分析和细胞实验
图右 动物实验设计及肝脏、结肠染色分析
活的和巴氏杀菌的A. muciniphila和EVs抑制LPS活化的LX-2细胞中TLR-2和TLR-4基因的表达
为研究A. muciniphila是否可以抑制 LX-2细胞中TLR-2和TLR-4的表达,该研究将活的和巴氏杀菌的A. muciniphila与三种不同的感染复数(MOI 1、10和100)和不同浓度(1、10 和50 μg/ml)EVs培养24小时。在LPS活化的LX-2细胞中,在MOI 10观察到活的和巴氏杀菌的A. muciniphila对TLR-2和TLR-4的基因表达的抑制作用最高。先前研究发现,与热灭活A. muciniphila相比,巴氏杀菌的A. muciniphila在MOI 1和100时显示出较低的TLR-4 mRNA水平,但热灭活和巴氏杀菌A. muciniphila在MOI 10时的效果几乎相同。50 μg/ ml EVs显著下调TLR-2和TLR-4表达。在静止期LX-2细胞中,虽然所有A. muciniphila处理都增加TLR-2和TLR-4的表达,但这种增加没有统计学意义。在静止细胞中,只有浓度为50 μg/ml 的EV才能下调TLR-2基因的表达。总体而言,与从热灭活的A. muciniphila获得的数据一致,表明活的和巴氏杀菌的A. muciniphila对静止期和LPS激活的LX-2细胞的影响不是剂量依赖性的,因为这两种形式在MOI 10时表现出最佳效果,而在EVs中观察到通过增加浓度来改善作用。
EVs可以有效地诱导激活的HSCs退化
在LPS激活的LX-2细胞中,经A. muciniphila处理的小鼠和未处理的对照小鼠的纤维化标志物的表达显著增加。巴氏杀菌A. muciniphila可以在MOI 10时下调纤维化标志物的表达,并且这种抑制作用对TGF-β和α-SMA在MOI 100时也可见。几乎所有感染复数下活A. muciniphila显著降低纤维化标志物的基因表达;而胶原蛋白的这种减少仅在MOI 10时观察到。与先前研究相比,巴氏杀菌A. muciniphila处理的纤维化标志物的mRNA水平低于热杀死的A. muciniphila,但热灭活和巴氏杀菌A. muciniphila的最佳剂量相同(MOI 10)。EVs对纤维化标志物表达的抑制作用呈剂量依赖性,在50 μg/ml的浓度下观察到最高的抗纤维化特性。这些观察结果表明EVs可以更有效地逆转HSCs的激活。
口服管饲A. muciniphila可防止HFD/CCL4诱导的肝损伤
动物实验表明,与PBS组相比,A. muciniphila处理的这些小鼠显示出轻微的体重增加。组织病理学分析证实,与正常饮食(ND)组相比,PBS组发生急性肝损伤。苏木精和伊红(H&E)和马森三色肝染色显示,PBS组中炎症细胞浸润严重,巴氏杀菌A. muciniphila(Pam)组中炎症细胞浸润较轻,而在活A. muciniphila(Am)和细胞外囊泡(EV)组中几乎没有观察到纤维化诱导作用。在PBS和Pam组中,肝实质中受损的肝细胞周围以及中肝脏的门静脉部分周围发生细胞周围纤维化。此外,与其他组相比,在PBS组中观察到肝细胞内存在大小液滴。评估所有A. muciniphila治疗对结肠组织病理学的影响显示,PBS组小鼠结肠组织固有层和上皮炎性细胞(包括单核细胞、嗜酸性粒细胞、浆细胞和多形核细胞)局灶性浸润,而Am和EV组中不存在炎症反应。与正常饮食(ND)组相比,PBS组结肠黏液层的隐窝深度和厚度显著降低;与PBS组相比,Pam、Am和EV组黏液层的隐窝深度和厚度增加。
EVs的抗炎作用
为研究活A. muciniphila、巴氏杀菌A. muciniphila和A. muciniphila的EVs的抗炎作用,评估TNF-α、白细胞介素6(IL-6)和IL-10的血清水平发现,与ND组相比,PBS组中TNF-α和IL-6显著增加,IL-10显著降低。有趣的是,所有治疗都可以显著降低血清TNF-α和IL-6水平,同时增加IL-10水平。这些抗炎作用在EV组中比在其他组中更明显,这表明A. muciniphila可能通过调节血清细胞因子来抑制肝纤维化,这在EV组中更为明显。
A. muciniphila改善HFD/CCL4诱导的肝损伤小鼠的血清生化和肝酶
血清肝酶水平评估显示,与ND组相比,PBS组的丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平显著增加。每日口服管饲所有的A. muciniphila都能够降低血清ALT和AST水平,而在Am和EV组中,这种改善比Pam组更显著。HFD / CCL4导致血清中谷氨酸、总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白(LDL)和极低密度脂蛋白(VLDL)的水平显著增加,而PBS组血清中高密度脂蛋白(HDL)的水平与ND组相反。与PBS组相比,施用两种形式的A. muciniphila和EVs降低了血糖,尤其是在Am组中。此外,与PBS组相比,Am和EV组的血清TG和TC水平显著降低,而Pam 组的TC水平与PBS组相比没有显著差异,A. muciniphila对TG的效果也没有该研究中使用的其他形式重要。与PBS组相比,所有A. muciniphila形式和EVs均显著降低LDL。尽管VLDL在所有组中均显著降低,但与PBS组相比Am组和EV组的降低幅度最大。令人惊讶的是,HDL的最高增量效应与两组之间的EV相关。总体而言,这些结果表明A. muciniphila及其EVs可以通过使血清葡萄糖、脂质谱和肝酶正常化来预防肝纤维化。
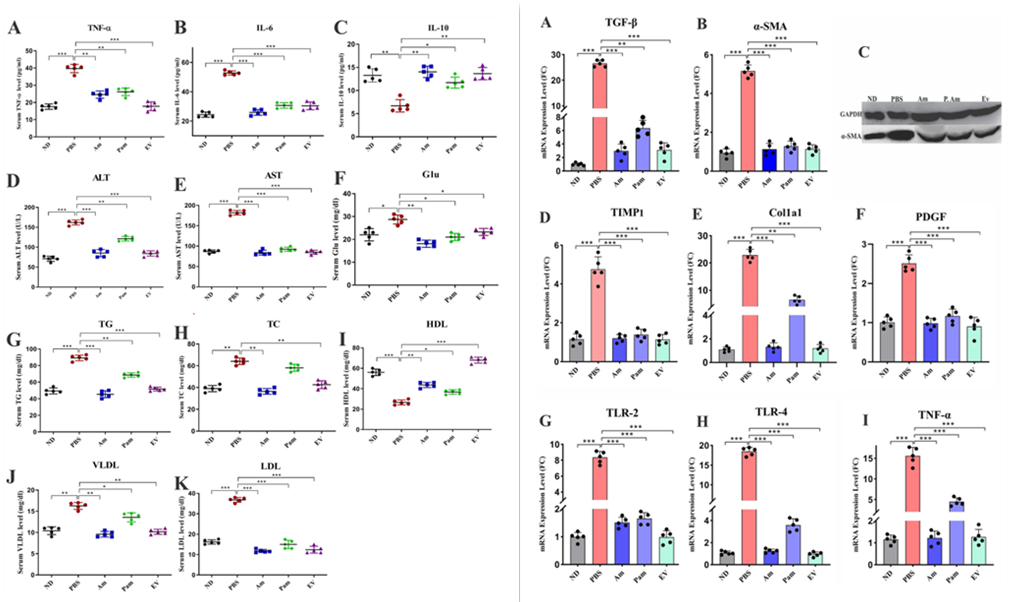
图左 血清生化和细胞因子测量
图右 肝脏纤维化和炎症相关基因的mRNA表达分析
EVs和A. muciniphila治疗降低小鼠肝组织中的纤维化标志物
为探索A. muciniphila及其EVs对肝纤维化的保护作用,该研究评估了小鼠肝组织中纤维化标志物的基因表达。与ND组相比,HFD/CCL4显著上调PBS组纤维化标志物的基因表达。基因表达分析表明,活的A. muciniphila及其EVs调节α-SMA、PDGF、TIMP1、TGF-β和Col1a1基因的表达。Pam组对col1和TGF-β的抑制效果显著比其他两组少。这些结果表明,给予活的和巴氏杀菌的A. muciniphila及其EVs可以通过抑制α-SMA、PDGF、TIMP和Col1a1基因的表达来减少HFD/CCl4诱导的肝损伤。
A. muciniphila及其EVs通过减少炎症来预防肝纤维化
为研究A. muciniphila对肝组织炎症状态的影响,该研究评估HFD/CCl4小鼠中TLR-2、TLR-4和TNF-α基因的表达发现,与ND组相比,PBS组中这些炎症标志物的基因表达显著增加。与PBS组相比,所有细菌形式的这些基因的mRNA表达水平均显著降低。这种抑制作用在所有研究组中都相似,表明各种形式的A. muciniphila都可以下调肝组织中炎症基因的表达,从而抑制HFD/CCl4诱导的肝损伤。
口服A. muciniphila及其EVs改善HFD /四氯化碳处理的小鼠肠道屏障的完整性
由于肠粘膜通透性和炎症的增加直接影响肝功能障碍,因此评估HFD/CCL4处理的小鼠结肠组织中ZO-1、TLR-2、TLR-4和TNF-α的表达。结果显示,施用各种形式的A. muciniphila及其EVs可以提高结肠组织中ZO-1的mRNA的表达,而它在PBS组中显著下调。与PBS相比,TLR-2是另一个在所有治疗组中上调的因素,然而,在Am组中观察到最高的增加。与PBS组相比,所有治疗组TLR-4和TNF-α的表达均显著下调。这些结果表明,用活的和巴氏杀菌的A. muciniphila及其EVs进行口服灌胃能够改善肠道屏障的功能,改善结肠的炎症反应,并可能诱导肠道免疫止血。
A. muciniphila在HFD/CCL4处理的小鼠结肠组织的抗纤维化效果
在该研究中,HFD和CCL4注射导致PBS组中α-SMA、PDGF和TGF-β基因的过度表达。有趣的是,所有形式的A. muciniphila及其EVs对结肠中的这些纤维化基因标志物都有抑制作用。然而,活的A. muciniphila及其EVs比巴氏杀菌A. muciniphila更显著地下调α-SMA和TGF-β的表达。所有形式的A. muciniphila及其EVs对PDGF都表现出显著的抑制作用。总的来说,A. muciniphila和EVs不仅可以下调肝脏中的纤维化标志物,还可以下调结肠组织中的纤维化标志物。
A. muciniphila及其EVs可改善附睾白色脂肪组织的炎症和纤维化
在慢性肝损伤中,脂肪组织发炎并表现出功能障碍的特征。因此,该研究检查了小鼠附睾白色脂肪组织(eWAT)中炎症和纤维化基因的表达。在PBS组中,纤维化基因(包括 α-SMA、PDGF和TGF-β)以及促炎基因(如TNF-α和IL-6)过表达,而抗炎基因IL-10降低。结果表明,与巴氏杀菌的A. muciniphila相比,活的A. muciniphila及其EVs可以下调α-SMA和IL-6的基因表达并上调IL-10。这些结果表明,使用A. muciniphila不仅可以改善肝脏和结肠功能,而且在eWAT中也显示出有希望的抗纤维化和抗炎作用。
A. muciniphila及其EVs对肾脏的抗纤维化作用
为研究EVs或各种形式的A. muciniphila是否对肾组织具有抗纤维化活性,评估各组之间的α-SMA、PDGF、Col1a1和TGF-β mRNA表达水平发现,CCl4处理显著增加PBS组中这些基因的表达。然而,尽管所有A. muciniphila处理都显著降低这些标志物的基因表达,但巴氏杀菌A. muciniphila对TGF-β下调的影响不如其他处理组显著。总体而言,这些结果表明使用的所有三种细菌形式对HFD/CCL4诱导的肾组织损伤都有显著的预防作用。
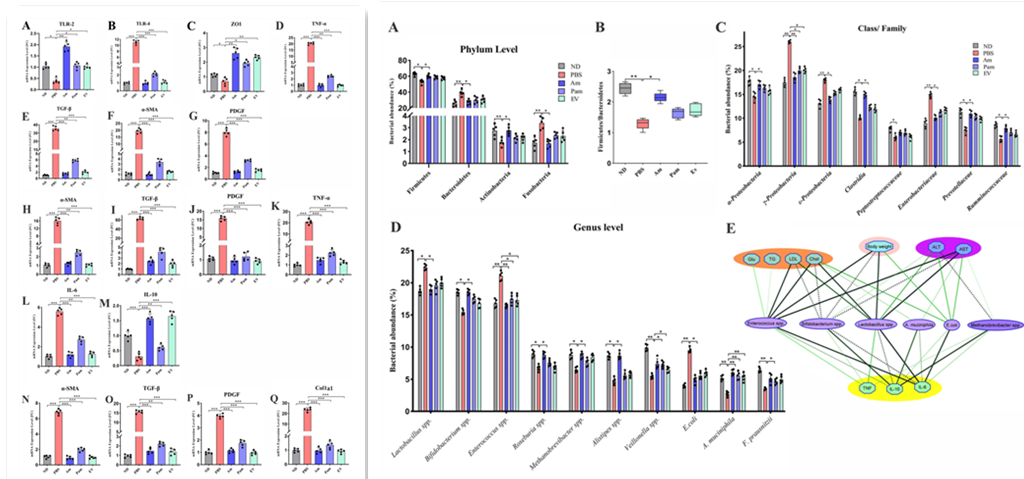
图左 所有A. muciniphila形式对结肠、脂肪和肾组织中炎症和纤维化相关标志物的mRNA表达水平的影响
图右 肠道微生物群组成及其相关性分析
使用活A. muciniphila后减少病原体
由于HFD影响肠道细菌组成并诱导肠道菌群失调,因此研究活的、巴氏杀菌的A. muciniphila及其EVs对肠道微生物群落的影响。与ND组相比,HFD/CCL4处理显著降低PBS组的厚壁菌门并增加拟杆菌门的相对丰度(PBS组为55.54% vs 37.88%,ND组65.13% vs 29.7%)在 ND 组中),而给予活A. muciniphila可以显著恢复这种不平衡(厚壁菌门61.67 % vs 拟杆菌门31%)。PBS组的厚壁菌门与拟杆菌门(F/B)的比率显著低于ND组,Am组的F/B比值显著高于PBS组。与ND组相比,HFD/CCl4显著增加PBS组中梭杆菌门并减少放线菌门的相对丰度,而只有活的A. muciniphila可以显著平衡这两个门。在纲/科级上,PBS组中γ-变形菌纲、ε-变形菌纲、肠杆菌科显著增加,而活A. muciniphila能够显著增加梭菌、瘤胃菌科和普雷沃菌科。在属/种水平上,乳酸杆菌属和大肠杆菌在PB中比ND组富集,而双歧杆菌属、罗氏菌属、甲烷短杆菌属、另枝菌属、韦荣氏球菌属和普氏栖粪杆菌在ND组和Am组中比PBS组更丰富。不出所料,所有处理组中A. muciniphila的相对百分比均高于PBS 组,这表明经口管饲4周后活菌定植成功。经口管饲巴氏杀菌的A. muciniphila及其EVs后也可能诱导A. muciniphila生长。巴氏杀菌的A. muciniphila还可以改变小鼠的肠道目标微生物γ-变形菌纲、韦荣氏球菌属和肠球菌属群。此外,与PBS组相比,EVs对小鼠肠道靶标的微生物γ-变形菌纲和肠球菌属群产生积极影响。这些数据证明活A. muciniphila具有减少病原体的相对丰度并增加共生体的能力,从而将目标的微生物组结构转变为与ND组相似。
A. muciniphila通过使靶向肠道微生物组的小鼠正常化来调节宿主对HFD/CCl4诱导的肝损伤的反应
为进一步解释肠道微生物组结构的影响,该研究评估了属/种水平的细菌相对丰度与血液生物标志物之间的相关分析。肠球菌属,在PBS组中更加丰富,与血清中TG、TC、LDL和Glu的水平呈正相关。血清中TC和LDL的水平也与乳酸杆菌属呈正相关。此外,大肠杆菌与TC呈正相关。相反,TC水平与有益细菌如A. muciniphila和双歧杆菌呈负相关,它们在 ND 和 Am 组中更丰富。双歧杆菌属还显示与LDL负相关。肠球菌属、乳杆菌属、大肠杆菌也表现出与血清促炎细胞因子(IL-6、TNF-α)的正相关性,而与抗炎细胞因子IL-10成反比。ALT作为肝损伤最重要的血液生物标志物之一,与甲烷短杆菌属和双歧杆菌呈负相关,并且与大肠杆菌和乳杆菌属正相关。另一种肝酶AST与甲烷短杆菌、双歧杆菌属和A. muciniphila呈负相关,而与肠球菌属、乳杆菌属和大肠杆菌呈正相关。同样,体重也与肠球菌属、乳杆菌属和大肠杆菌呈正相关,与双歧杆菌呈负相关。这些数据表明肠道微生物群对调节宿主响应HFD/CCl4挑战的有益影响。
研究结论
总之,该研究表明,口服活的和巴氏杀菌的A. muciniphila及其EVs可以使粪便靶向细菌组成正常化,改善肠道通透性,调节炎症反应,并随后预防HFD/CCl4导致的小鼠肝损伤。随着肠道和肝脏组织病理学的改善,HFD/CCl4诱导的肾脏损伤和脂肪组织炎症也通过不同的A. muciniphila治疗得到改善。

图 不同形式的A. muciniphila的口服给药对HFD/CCl4诱导的肝损伤的保护作用
研究报告原文详见:

文章仅供学术探讨,如需转载请注明出处。
 yzh@akkpro.com
yzh@akkpro.com


