欢迎您访问爱非克(深圳)生物科技有限公司
关键词:AKK菌
炎症性肠病(IBD)目前已成为一个全球性的疾病。
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD),在过去20年中随着发病率迅速增加它已成为全球负担。WTO将每年的5月19日定为炎症性肠病日,它曾被认为是“西方人的疾病”,以往在我国患病率很低,但近年来患病率呈现增加趋势,目前全球约有500多万炎症性肠病患者。
研究背景
研究发现在IBD患者中观察到高频率的心理障碍,例如抑郁或焦虑,抑郁症会影响IBD的严重程度,包括生活质量降低、住院、手术风险和IBD发作。心理障碍会导致肠道微生物群失调和结肠黏膜屏障损伤,从而增加患IBD的风险。
然而,心理障碍或抑郁症在IBD恶化中的作用背后的机制尚未得到充分探索。最新的证据表明,抑郁症加重IBD的危险因素与脑-肠轴密切相关,脑-肠轴被认为是大脑和肠道相互作用的双向联系,肠道被认为是显著影响大脑功能和结构的生物因素之一,而大脑也调节肠道微生物群和微环境,因此,筛选特定的肠道微生物在探索新的治疗选择方面起着重要作用。
结肠粘液被认为是有效保护结肠免受毒素和病原微生物入侵的第一道物理屏障,由广泛糖基化的粘蛋白2(MUC2)产生和维持,该粘蛋白由杯状细胞分泌,大约每小时更新一次内部粘液层。据报道,慢性应激引起的肠道通透性增强和肠道微生物群失调会导致粘膜免疫反应和肠道炎症。然而,肠道微生物群及其对脑-肠轴内结肠粘液的影响之间的关系值得进一步研究。该研究通过慢性束缚应激(CRS)建立小鼠抑郁模型,来研究CRS对葡聚糖硫酸钠(DSS)诱导的结肠炎的影响。此外,还进行肠道微生物群移植实验以研究肠道微生物群与结肠黏膜屏障之间的因果关系。
研究内容
实验1:慢性约束应激和葡聚糖硫酸钠诱导的结肠炎方案
32只小鼠被随机分配到四组:常规饲养(CB;n=8)、CRS(n=8)、葡聚糖硫酸钠(DSS;n=8)和DSS+CRS(n=8)。CRS和DSS+CRS组的小鼠连续30天被限制在50 ml通风良好的离心管中,3小时/天(上午9:00至12:00),期间不允许在手术过程中前后移动。30天后进行行为测试(露天试验、尾悬试验、强迫游泳测试)以评估CRS下的抑郁相关行为。然后,DSS和DSS+CRS组小鼠饮用2.5% (w/v) DSS 7天。在DSS给药后第8天,对所有实验组的小鼠进行安乐死以评估小鼠结肠长度和组织学评分。DSS+CRS组中的两只小鼠因严重的结肠炎在DSS给药期间导致意外死亡而从实验中移除。
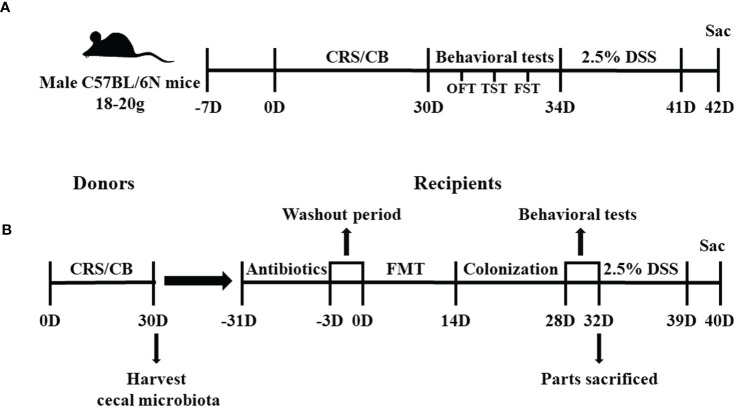
图 实验1和2的研究时间线
实验2:肠道微生物群移植和定植
72只小鼠被随机分配到八组:供体CB(N = 10)、供体CRS(N = 20)、受体-CB(RE-CB, n = 6)、受体-CRS(RE-CRS, N = 6)、受体CRS-Akkermansia muciniphila(RE-CRS-AKK, n = 6), 受体-CB-DSS(RE-CB-DSS, N = 8), 受体-CRS-DSS(RE-CRS-DSS, n = 8), 受体CRS-Akkermansia muciniphila-DSS(RE-CRS-AKK-DSS,N = 8)。将供体CRS组中的小鼠每天限制在离心管中3小时,连续30天。供体组中的所有小鼠在第31天被安乐死以收集盲肠微生物内容物用于粪便微生物群移植(FMT)。基于活动组(供体CB小鼠或供体CRS小鼠)将来自供体组的盲肠内容物混合一起至50 ml离心管中制成冻融悬液。接受组的小鼠在FMT前持续30天随意服用以下抗生素混合物:氨苄青霉素、新霉素、甲硝唑(均为1克/毫升)和万古霉素(0.5克/毫升),以耗尽所有肠道微生物群。在3天的洗脱期后,然后将100 μl冻融悬液通过口服管饲法给予每只受体小鼠,持续14天。此外,用CRS悬液处理的两个受体组分别口服100 μl含有1×108 CFU的A. muciniphila MucT(DSM 22959)和等体积PBS作为平行对照。在肠道微生物群定植后进行行为测试。在行为测试结束时,一些受体小鼠被安乐死,其他小鼠在饮用水中接受2.5% DSS 7天。收集小鼠结肠进行分析。
研究结果
实验一:CRS造成不良心理影响、结肠炎加重、微生物群失调
CRS诱发抑郁样行为和严重结肠炎。CRS动物模型在DSS给药前表现出抑郁样行为。与CB组相比,CRS小鼠在OFT中的运动距离显著缩短。此外,与CB组相比,在CRS条件下的小鼠中观察到不动性增加和游泳时间减少。在DSS暴露7天后,CRS小鼠出现严重的结肠炎,其特征是血性腹泻、炎症细胞严重浸润、肠壁广泛的绒毛损伤和反应性上皮细胞增生。DSS+CRS组的结肠长度短于DSS组。此外,DSS+CRS组的组织病理学评分高于DSS组。
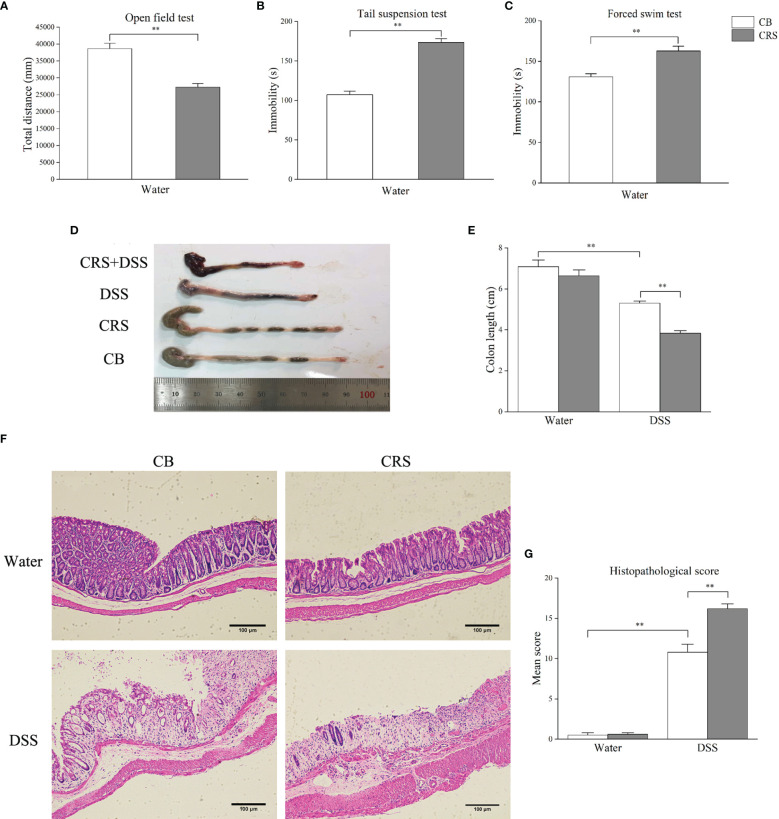
上图 CRS加重了DSS引起的结肠损伤
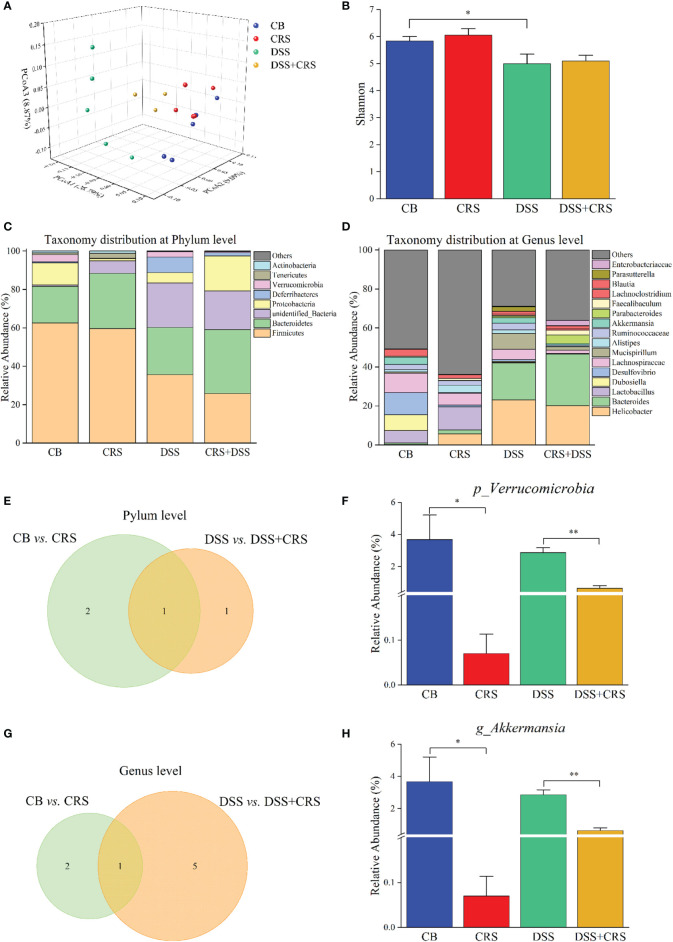
下图 在CRS小鼠中观察到A. muciniphila减少
A. muciniphila丰度在CRS小鼠中减少。利用16S rRNA测序来量化和表征CRS条件下小鼠的肠道微生物群,结果发现,与CB组相比,DSS组的香农指数下降,但从CB vs CRS和DSS vs DSS+CRS的比较中没有观察到alpha多样性的差异。未加权的UniFrac PCoA分析表明四组之间OTU水平的beta多样性存在明显差异。与CB组相比,CRS组小鼠的微生物组表现出基于ANOSIM值的显著变化。然而,当比较DSS组与DSS+CRS组时并没有发现差异。接下来分析每组的微生物群落结构发现,在门和属水平上,CRS组或DSS+CRS组的微生物群组成发生了显著变化。在门水平上,分别从CB vs CRS、DSS vs DSS+CRS的比较中确定了三个和两个优势门。与CB组相比,CRS组中变形菌门和疣微菌门的相对丰度降低,而黑色素杆菌门的相对丰度增加。CRS+DS组中变形菌门的相对丰度高于DSS组,疣微菌门相对丰度降低。在门水平上,疣微菌的相对丰度在两个比较中都显著降低。在属水平上,与CB组相比,CRS组中Odoribacter属的相对丰度增加,Akkermansia和Desulfovibrio属的相对丰度降低。此外,与DSS组相比,DSS+CRS组中Erysipelatoclostridium、Enterococcus、Parabacteroides属的比例显著增加,而Romboutsia、Dubosiella和Akkermansia属的比例减少。在门水平上,两个比较中接受CRS的小鼠表现出Akkermansia属丰度减少。
患有抑郁症的UC患者中A. muciniphila的患病率。为评估患有抑郁症的UC患者中A. muciniphila的患病率,从16名患有抑郁症的UC患者和19名UC患者中收集了总共35份粪便样本作为对照。实时 PCR数据进一步证实了患有抑郁症的 UC患者中A. muciniphila的丰度降低。最重要的是,这些结果表明CRS下较低丰度的A. muciniphila可能与结肠炎的加重有关。
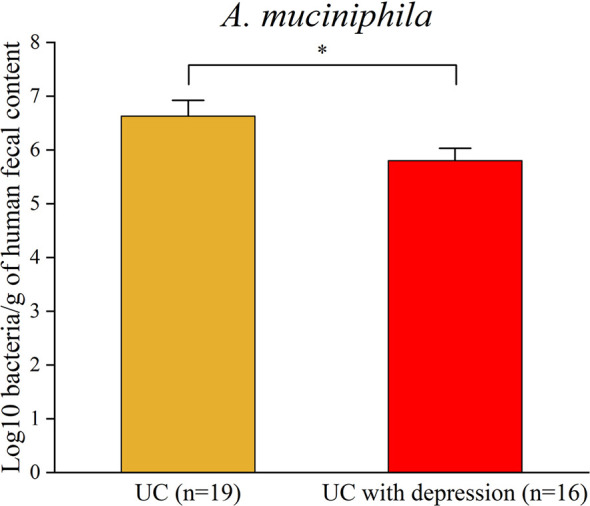

上图 实时 PCR分析证实患有抑郁症的UC患者中A. muciniphila的减少
下图 高通量RNA-Seq分析CRS下的DEG
CRS调控的差异表达基因与小鼠A. muciniphila的相互作用。为确定CRS如何在DSS诱导的结肠炎中发挥有害作用,该研究通过CB vs CRS以及DSS vs DSS+CRS的比较在小鼠结肠组织中进行了DEG分析,分别鉴定了3,523和2,621个DEGs。值得注意的是,在两次比较中,69个DEGs发生显著变化。当将CB与CRS小鼠进行比较时,10个最重要的GO terms表明CRS主要控制核糖体的结构成分、转录共调节活性和酶激活银子活性,KEGG通路分析表明CRS主要调节阿尔茨海默病、帕金森病和亨廷顿病。当将DSS与DSS+CRS小鼠进行比较时,10个最重要的GO terms表明CRS与受体配体、细胞因子和细胞因子受体活性有关,KEGG通路分析显示10条最富集的通路包括IL-17信号通路、TNF信号通路和Th17细胞分化通路。从上述两个比较中筛选出69个DEGs,并进行GO和KEGG通路分析,GO分析表明鉴定出的DEGs与脂肪酸结合、长链脂肪酸结合和Toll样受体结合有关;KEGG通路分析显示DEGs与IL-17、TNF和AMPK信号通路有关。
为验证宿主基因与改变的微生物群落之间的关系并确定它们在加重结肠炎严重程度方面的潜在作用,该研究对CRS和A. muciniphila调控的69个DEGs进行了相关分析,结果显示34个DEGs与A. muciniphila显著相关。值得注意的是,MUC2表达与A. muciniphila呈正相关。
CRS抑制结肠中的粘液产生和杯状细胞数量。进行qRT-PCR以验证从候选DEG中选择的MUC2的表达和相关性分析,结果表明CRS降低了MUC2的表达,CRS下小鼠每个绒毛中的MUC2阳性细胞显著减少。由于杯状细胞产生粘蛋白,该研究接下来检查了来自不同组的小鼠的结肠,并通过PAS/AB染色计算了杯状细胞的数量,结果显示,与非CRS小鼠相比,所有CRS小鼠的杯状细胞数量显著减少。

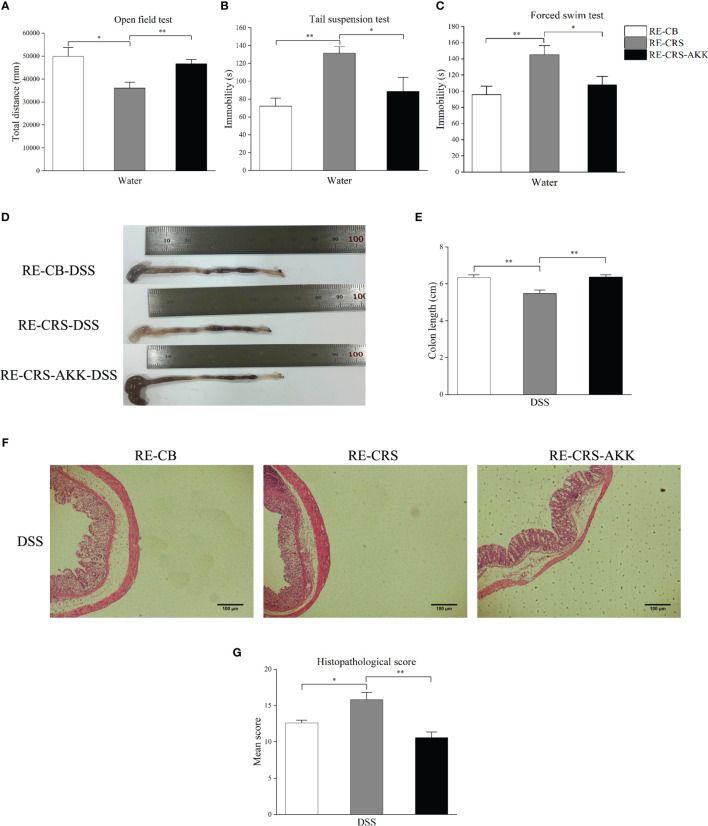
上图 慢性束缚应激促使结肠黏膜屏障受损
下图 补充A. muciniphila减轻了受体小鼠的抑郁样行为和结肠炎加重
实验二:补充A. muciniphila能预防粘膜屏障缺陷和结肠炎加重
补充A. muciniphila可减轻受体小鼠的抑郁样行为和加重结肠炎。为进一步评估CRS驱动的生态失调在与A. muciniphila相关的结肠炎恶化中的作用,该研究在受体小鼠中进行了 FMT。与CB菌群定植的受体小鼠相比,CRS菌群定植的受体小鼠在OFT、TST和FST中表现出更多的抑郁样行为。与定植CRS微生物群的受体小鼠相比,补充A. muciniphila减轻了抑郁样行为,包括减少TST和FST的不动时间,以及增加OFT的运动距离。在DSS给药7天后,与CB微生物群相比,在CRS微生物群定植的受体小鼠中观察到显著的严重结肠炎。相反,与CRS微生物群定植的受体小鼠相比,补充A. muciniphila增加了结肠长度并降低了组织病理学评分。
补充A. muciniphila抑制受体小鼠结肠粘膜屏障损伤。为阐明肠道微生物群的失调是否是结肠黏膜屏障缺陷的原因,该研究分析了受体小鼠的黏膜屏障功能。定植CRS微生物群的小鼠在DSS暴露前后表现出结肠黏膜屏障破坏,而补充A. muciniphila显著增强MUC2的表达,并增加每个绒毛中杯状细胞和MUC2阳性细胞的数量。
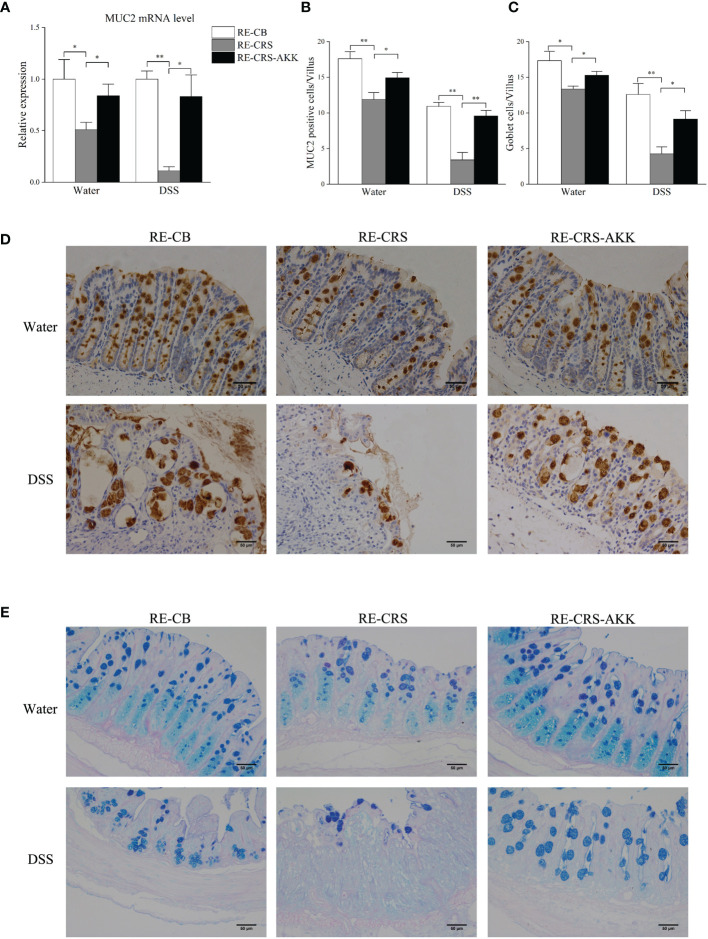
上图 补充A. muciniphila保护受体小鼠的结肠粘膜缺陷
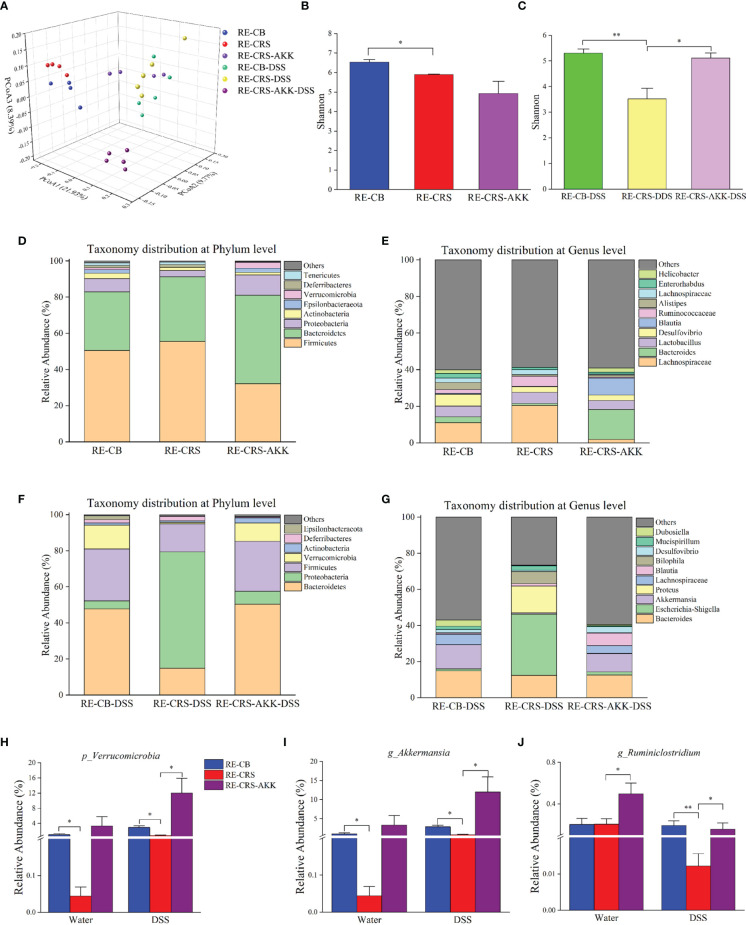
下图 补充A. muciniphila重塑了受体小鼠的肠道微生物群
补充A. muciniphila改造了受体小鼠的肠道微生物群。基于16S rRNA 测序,香农多样性指数显示,与定植 CRS微生物群的受体小鼠相比,在DSS暴露后补充A. muciniphila增加了α多样性。此外,与接种CB微生物群的受体小鼠相比,添加A. muciniphila前后的香农多样性指数没有显著差异,表明在A. muciniphila治疗后部分恢复了α多样性。ANOSIM分析表明,与CRS微生物群定植的小鼠相比,在DSS给药前后,补充A. muciniphila导致不同的肠道微生物群落。与实验1一致,在DSS给药前后,CR菌群定植的小鼠中疣微菌门和Akkermansia属的相对丰度比CB菌群定植的小鼠低。在DSS暴露后补充A. muciniphila显著增加了疣微菌门和Akkermansia属的相对丰度。值得注意的是,补充A. muciniphila显著增强Ruminiclostridium属的相对丰度。
研究结论
该研究证实了慢性束缚应激(CRS)条件下的小鼠表现出微生物群组成的改变、结肠粘液的破坏和结肠炎的加重。此外,Akkermansia muciniphila的丰度在CRS和UC抑郁症患者中显著降低,并与MUC2的表达呈正相关。抗生素处理后定植CRS微生物群的受体小鼠表现出屏障缺陷和严重的结肠炎。补充Akkermansia muciniphila可以恢复结肠粘液并改变肠道微生物群。该研究结果表明,A. muciniphila有望成为一种潜在的益生菌,用于保护和治疗伴有心理障碍的IBD患者,这些心理障碍与结肠粘液的损伤有关。
研究报告原文详见

「文章仅供学术探讨,如需转载请注明出处。」
 yzh@akkpro.com
yzh@akkpro.com


