欢迎您访问爱非克(深圳)生物科技有限公司
关键词:AKK菌
代谢类疾病有多种类型,且疾病负担较重,已成为制约人类健康预期寿命的重要因素。
随着经济发展,人民生活水平的提高,为满足口腹之欲而摄入许多高糖高脂以及高嘌呤食物明显增加,不健康的饮食引起肠道不适,继而深化影响到人体代谢紊乱。近年来,我国代谢性疾病发病率呈上升趋势,且严重影响了人体健康。
研究背景
在过去三十年中代谢性疾病的患病率越来越高。众所周知,肠道微生物群(包括 Akkermansia muciniphila)可调节人体的能量代谢、葡萄糖耐量、免疫系统成熟和功能。一些研究表明, A. muciniphila丰度与代谢紊乱(如肥胖和2型糖尿病)相关,并且补充活的或巴氏杀菌的A. muciniphila可改善代谢性内毒素血症并改善肠道屏障功能,从而改善全身代谢。A. muciniphila诱导一种独特的免疫反应类型,涉及稳态抗原特异性IgG抗体和T细胞反应,以及结直肠癌模型中的细胞毒性T细胞反应。此外,在高脂肪饮食(HFD)喂养的小鼠中,A. muciniphila激活脂肪组织驻留的调节性T细胞,其成分Amuc_1100据报道与Toll样受体2相互作用。但是,几乎没有证据表明涉及A. muciniphila的有益作用的机制,包括特定的宿主细胞成分或细菌蛋白。特别是缺乏对A. muciniphila与宿主脂肪组织库—包括介导非颤抖产热的肩胛间棕色脂肪组织(iBAT)—之间关系的研究。肠道微生物群也会影响肠内分泌系统,并通过微生物衍生的代谢物或细胞膜成分调节宿主免疫系统。特别是细菌代谢物,如短链脂肪酸(SCFAs)、次级胆汁酸、吲哚和脂多糖,通过刺激肠道激素(如GLP-1)的释放和通过激活肠道神经元信号传导来调节食欲,这有助于能量稳态。虽然已知A. muciniphila会影响肠道中释放肠道激素的L细胞,但缺乏参与GLP-1分泌的A. muciniphila生物活性分子的证据。
研究内容
A. muciniphila菌株的分离和培养:A. muciniphila(ATCC-BAA-835)孵育培养后,从板中收集细菌悬浮在含有甘油的厌氧磷酸盐缓冲盐水(PBS)中。每只小鼠口服200μl含4.0×108 CFU A. muciniphila的厌氧PBS悬浮液。A. muciniphila(SNUG-61027)是从前一年未接受抗生素治疗的三名健康个体中新鲜收集的粪便样本中分离出来的,16S-rRNA序列基本局部比对搜索工具分析表明,该分离物与ATCC-BAA-835 100%相似。
动物实验:C57BL/6J小鼠(SLC)在12/12 h(光/暗)的循环下被安置在无病原体的动物设施中(每个笼子不超过四只),并给予自由获取食物和水的机会。(1)C57BL/6J雄性小鼠(6周龄)喂食低脂饮食、HFD或喂食HFD并且每天一起施用A. muciniphila,持续14周,每组小鼠为n = 7-10只,将小鼠的体重匹配并随机分配。每周测量一次食物摄入量和体重。在治疗期结束时,对小鼠进行安乐死和分析。(2)C57BL/6J雄性小鼠(6周龄)喂食低脂饮食、HFD或在HFD喂养期间口服(或腹腔)来自A. muciniphila的纯化蛋白P9(每只小鼠100μg),每组小鼠n = 8,在8周时对小鼠实施安乐死后进行分析。(3)比较分析P9在IL-6-基因敲除(KO) HFD喂养小鼠和野生型(WT)小鼠中的作用。使用IL-6-KO的C57BL/6J雄性小鼠(6周龄),WT小鼠雄性小鼠(6周龄)作为对照,分为WT:HFD(n = 8)、HFD + P9(n = 8);IL-6-KO:HFD(n=6)、HFD+ P9(n=6)。所有小鼠最初都适应环境1周,同时食用正常饮食,并在相同的条件下在同一设施中饲养。HFD对IL-6-KO和WT小鼠代谢(包括血糖,体重增加和食物摄入)的影响相似。在实验结束时,用异氟醚麻醉动物,并通过眶后窦穿刺收集血液样本,然后通过颈椎脱位杀死小鼠。
对小鼠进行葡萄糖和胰岛素耐量测试。收集小鼠血浆测量血浆胰岛素浓度和血浆GLP-1浓度。用P9(50 μg/ml)处理30分钟后从NCI-H716细胞中提取RNA进行RNA-seq分析。收集小鼠盲肠进行盲肠代谢物分析和盲肠微生物群的分析。C57BL/6J小鼠喂食60% HFD,并口服施用200 μl P9(每只小鼠100μg)或相同体积的无内毒素蒸馏水10 d。将小鼠单独放入代谢室(Oxylet系统,Panlab-Harvard设备)中,并在进行测量之前适应2天,然后进行间接量热法和身体成分测量。
研究结果
与HFD喂养的小鼠相比,口服A. muciniphila(ATCC-BAA-835)显著降低小鼠体重,改善了葡萄糖耐量,并增加血浆中胰岛素和β氧化基因标志物的浓度。有趣的是,A. muciniphila治疗的HFD喂养小鼠中iBAT的质量和大小较低,而附睾白色脂肪组织(epWAT)的质量和大小不受A. muciniphila治疗的影响。这些结果与最近的发现一致,即给予活的A. muciniphila不影响epWAT脂肪细胞直径或脂肪量,这表明在A. muciniphila治疗后iBAT有特异性损失。接下来通过分析产热基因转录评估iBAT的功能代谢能力。在A. muciniphila治疗的HFD喂养小鼠的 iBAT中观察到编码解偶联蛋白1(Ucp1)的线粒体特异性基因和相关产热分化标记转录本的显著诱导,但在腹股沟WAT(igWAT)中没有观察到,这意味着A. muciniphila的抗肥胖作用通过iBAT而不是igWAT起作用。与对照组相比,使用A. muciniphila给药的HFD喂养小鼠的iBAT皮肤温度以及直肠温度显著更高。此外,在用A. muciniphila给药的小鼠中,iBAT中抗炎M2巨噬细胞(CD11b + CD206 +)的数量显著更高。
A. muciniphila和S24-7(也称为Muribaculaceae)科属在口服A. muciniphila的小鼠中更丰富。同样地,A. muciniphila的16S rRNA基因计数与iBAT温度和血浆GLP-1浓度呈正相关,并且与葡萄糖不耐受水平呈负相关。此外,A. muciniphila给药小鼠的iBAT中M2巨噬细胞标志物的转录本增加。这些结果表明,A. muciniphila影响小鼠iBAT的产热活性和iBAT特异性M2样巨噬细胞的丰度。
为评估iBAT中产热基因上调的潜在机制,该研究比较了口服活的A. muciniphila和对照HFD喂养小鼠之间的盲肠代谢物。与对照组相比,尽管治疗小鼠的盲肠内容物中肌酸和甘氨酸的浓度较高,但差异很小。因此,该研究得出结论,A. muciniphila治疗对盲肠代谢物没有重大影响。
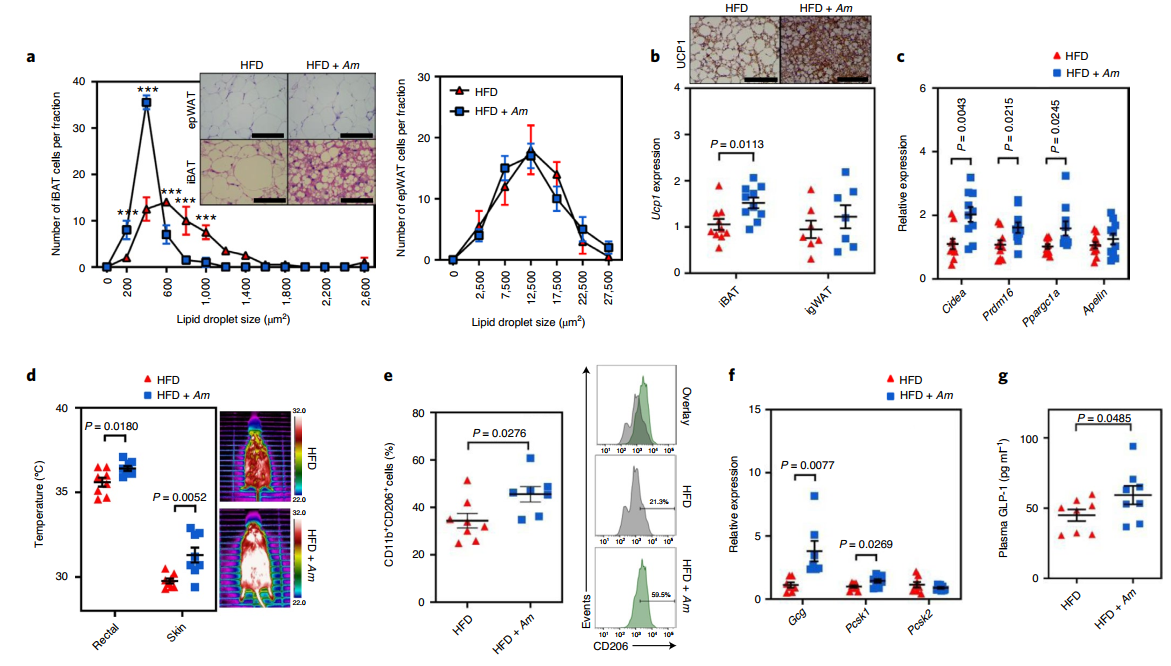
图 A. muciniphila激活棕色脂肪细胞,诱导GLP-1的表达
GLP-1调节BAT产热,因此接下来研究了口服A. muciniphila是否会影响培养的L细胞和HFD喂养小鼠中的GLP-1表达。由于大多数分泌GLP-1的L细胞位于回肠远端,因此测量了口服给药A. muciniphila后HFD喂养小鼠回肠中的GLP-1表达。在每组小鼠中测量Gcg(编码GLP-1或胰高血糖素)、Pcsk1和Pcsk2的转录。与对照组相比,在用A. muciniphila给药的HFD喂养小鼠中发现Gcg和Pcsk1的表达要高得多。同样,与对照组相比,口服A. muciniphila的HFD喂养小鼠的血浆GLP-1浓度更高。
接下来为确定A. muciniphila如何诱导GLP-1分泌,该研究用活的A. muciniphila(SNUG-61027或ATCC-BAA-835)颗粒或细菌悬浮液处理人肠内分泌L细胞(NCI-H716),然后测量GLP-1浓度。结果发现,无细胞上清液(CFS)显著增加GLP-1浓度,而细菌沉淀则没有。为确定这种效应是否具有剂量依赖性,该研究用10-100%(v/v)浓度的A. muciniphila CFS处理NCI-H716细胞,发现GLP-1以剂量依赖性方式被诱导。此外也用从人类粪便中分离出的23种乳酸杆菌和24种双歧杆菌菌株测试NCI-H716细胞分泌GLP-1的影响。ATCC-BAA-835和新分离的SNUG-61027的CFS(10% v/v)强烈诱导GLP-1分泌,而所有47种菌株的CFS均无效果。
由于肠内分泌细胞可以通过增加其GLP-1、乙酸盐和丙酸盐的分泌来对SCFAs作出反应,因此将存在于A. muciniphila CFS中这些施用于肠内分泌细胞。然而,虽然GLP-1分泌增加,但其增加幅度不如在CFS中观察到的增加那么多,这表明SCFAs并不是唯一诱导GLP-1分泌的细菌产物。
为了鉴定负责GLP-1分泌的A. muciniphila其他衍生分子,将培养的A. muciniphila CFS(SNUG-61027)过滤以产生一系列组分。每个组分使用5 mg处理NCI-H716细胞,并测量GLP-1分泌。有趣的是,100-300 kDa滤液显著增加了GLP-1的分泌,30-100 kDa滤液增加的程度较轻。用蛋白酶K处理消除两种组分的作用,表明负责诱导GLP-1分泌的一个或多个分子可能是一种蛋白质。为了分离A. muciniphila产生的候选蛋白,将SNUG-61027的100-300 kDa滤液和对照培养基(均含有约25 mg/ml蛋白)通过阴离子交换Mono Q柱,收集的组分用于处理NCI-H716细胞并测量GLP-1浓度。m2-m4级分诱导GLP-1分泌;因此,将这些组分浓缩并施加到尺寸排阻柱上以获得进一步细分的组分,测试其诱导GLP-1分泌的能力。其中,G17-G20组分诱导L细胞分泌最多的GLP-1。
使用液相色谱法结合串联质谱法(LC-MS / MS)对这些组分进行进一步分析,以确定负责GLP-1分泌的蛋白质。分析了从尺寸截止过滤的100-300 kDa滤液(样品1)、离子交换色谱产物(样品2)和尺寸排阻色谱产物(样品3)中获得的约90 μg蛋白质。排除在候选蛋白质列表中存在于基础培养基中的牛特异性蛋白质,鉴定出98个A. muciniphila衍生蛋白和130个牛特异性蛋白:样品1中有95个,样品2中有36个,样品3中有10个。
为研究A. muciniphila衍生蛋白的作用,该研究克隆了与样品3(方法)中鉴定的蛋白相对应的cDNA,并测试了每种蛋白在L细胞中诱导GLP-1分泌的能力,使用来自ATCC-BAA-835的外膜蛋白Amuc_1100为对照。使用SDS聚丙烯酰胺凝胶电泳从每个质粒中产出正确大小的单个蛋白质,每种蛋白质的序列与该类型菌株(ATCC-BAA-835)产生的等效蛋白质具有很高的相似性(>98%)。
该研究用表达的9种蛋白质中的每一种处理NCI-H716细胞,发现在NCI-H716细胞中P1(UniProt:B2UKW8)、P5(UniProt:B2URM2)和P9(UniProt:B2UM07)以剂量依赖性方式诱导GLP-1。然而,与P9相比,Amuc_1100诱导GLP-1分泌的作用可以忽略不计。在人类原代肠上皮细胞中也证实P9诱导GLP-1。为确定这些影响是否也存在于喂食正常饮食的小鼠中,每天腹腔注射每种蛋白质2周,并比较其体重增加和葡萄糖耐量。在用P9治疗的小鼠中显示出显著的体重减轻和葡萄糖不耐受的降低,与其他蛋白质的作用相反。此外,为验证来自其他肠道细菌的与P9同源的克隆蛋白是否具有与P9相似的作用,并且P9属于肽酶S41A家族,该研究从大肠杆菌(EcPrc)克隆了与P9等效的S41成员,并将其在NCI-H716细胞中诱导GLP-1的能力与来自A. muciniphila的P9的能力进行比较。有趣的是,在L细胞中来自A. muciniphila的P9诱导了GLP-1,但EcPrc没有,这表明A. muciniphila衍生的P9对GLP-1的分泌具有特异性作用。
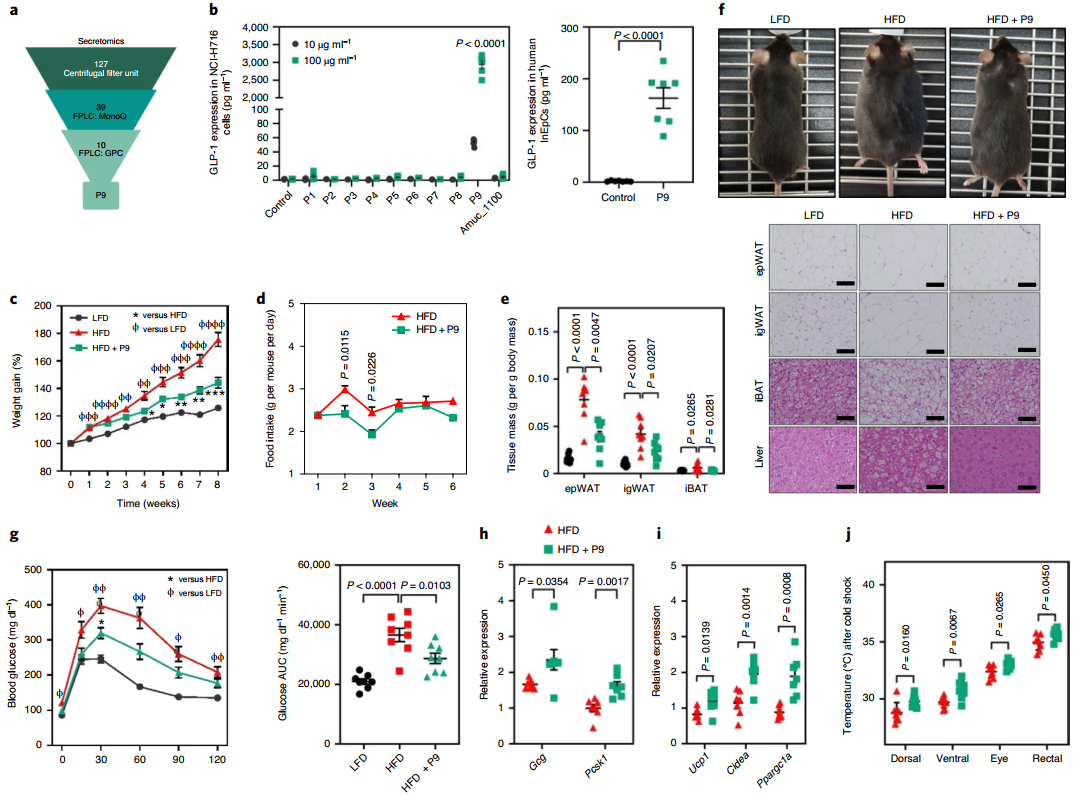
图 一种从A. muciniphila中纯化的GLP-1诱导蛋白P9,通过促进产热作用来改善肥胖并影响葡萄糖稳态
该研究还比较了小鼠中P9与已酸盐和丙酸盐对GLP-1分泌的影响。单次腹腔注射P9诱导高水平的GLP-1分泌,而小鼠中腹腔注射SCFAs或EcPrc则没有,这表明与其他GLP-1诱导剂(如体内SCFAs)相比,A. muciniphila衍生的P9通过不同的机制诱导GLP-1。
在持续8周每天口服P9的HFD喂养小鼠中也获得了一致的结果—与对照组相比,喂食P9的小鼠显示出体重增加和食物摄入量显著降低。小鼠的脂肪组织体积和葡萄糖耐受也显著降低,而回肠中GCg和Pcsk1的表达显著较高。此外,P9诱导产热,室温和冷休克后BAT特异性基因的表达以及体温显著增加。身体成分分析显示,瘦体重和脂肪量明显较高。此外,间接量热法显示,用P9给药的小鼠具有较低的呼吸商和较高的脂肪酸氧化,尽管在能量消耗方面没有任何差异。总的来说,这些结果表明P9的施用通过调节葡萄糖稳态和通过iBAT诱导产热来预防肥胖。
接下来为确定P9如何诱导更高的GLP-1表达,RNA测序(RNA-seq)分析P9处理的NCI-H716和对照细胞。值得注意的是,P9诱导编码钙相关信号蛋白的基因表达。此外,磷酸激酶测定发现P9增加了磷酸化cAMP反应元件结合蛋白(p-CREB)和磷酸化热休克蛋白27(p-HSP27)的表达。钙流入量显著升高,钙抑制剂预处理降低了P9诱导的GLP-1表达。
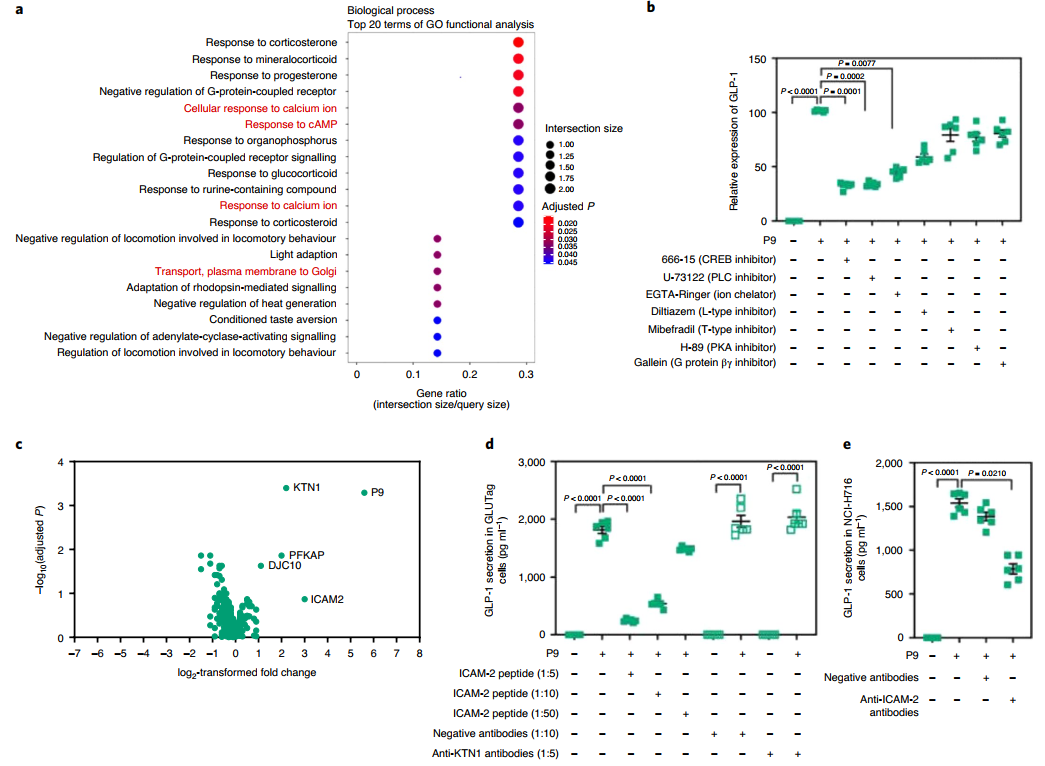
图 P9通过Ca2 +依赖途径和iCaM-2诱导GLP-1分泌
GLP-1受体β-抑制蛋白测定证实P9不与GLP-1受体结合。此外,G蛋白偶联受体(GPCR)组胺H1受体、α-1β肾上腺素能受体和毒蕈碱乙酰胆碱受体M1的抑制剂预处理未改变P9处理后L细胞的GLP-1分泌。为了鉴定P9的受体,该研究使用配体—受体捕获(LRC)-TriCEPS技术进行蛋白质结合测定,使用LC-MS/MS鉴定NCI-H716细胞中与P9结合的细胞蛋白。富集度最高的P9结合蛋白是驱动结合蛋白1(KTN1),富集度最高的蛋白质是ICAM-2。因此用ICAM-2肽、抗ICAM-2或抗-KTN1抗体预处理细胞,并测量P9诱导的GLP-1分泌。有趣的是,ICAM-2肽以剂量依赖性方式显著降低了P9诱导的GLP-1分泌。接下来为确定与ICAM-2相互作用的重要性,使用抗-ICAM-2抗体预处理细胞并测量P9的作用。通过这种方式GLP-1的分泌显著减少,然而,抑制水平不足以阻止ICAM-2的整个效果。这些结果表明,P9直接与ICAM-2结合。
据报道,运动诱导的白细胞介素-6(IL-6)分泌增加刺激肠道L细胞和胰腺α细胞分泌GLP-1,从而促进胰岛素分泌。最近,促炎刺激,如内毒素和IL-1β,已被证明以IL-6依赖性方式诱导GLP-1分泌,导致血糖降低。因此,该研究假设P9不仅可能诱导GLP-1,还可能诱导IL-6,IL-6调节葡萄糖稳态。该研究通过实验发现P9强烈诱导巨噬细胞系中的IL-6表达。还发现A. muciniphila诱导特定的细胞因子表达模式,表现为HFD喂养小鼠的回肠和结肠以及体外巨噬细胞和结肠上皮细胞中IL-6的上调,而不是肿瘤坏死因子α。IL-6增加永生化棕色前脂肪细胞(BCAs)中的产热基因表达。同样,IL-6处理从HFD喂养小鼠获得的原代前脂肪细胞后显著增加Ucp1的表达。IL-6在GLUTag细胞中诱导GLP-1,尽管与P9处理组相比程度较小,并且与P9处理组相比,P9和IL-6处理后观察到GLP-1分泌的累加效应。
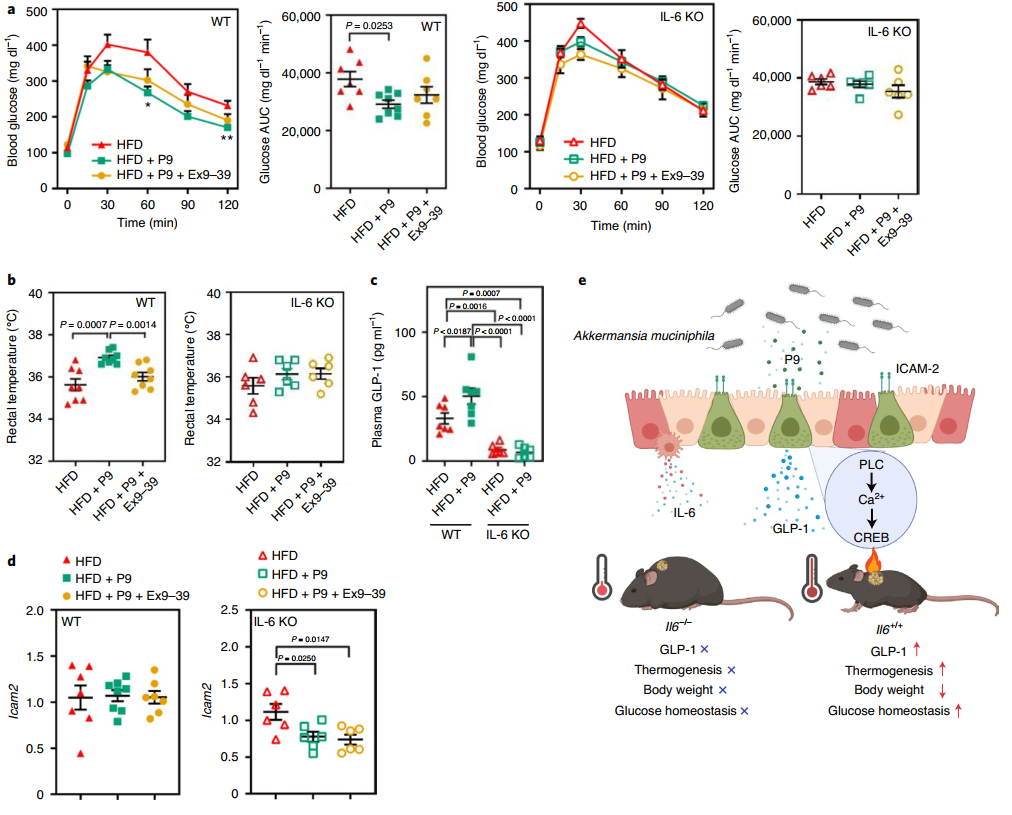
图 P9通过GLP-1R信号通路和IL-6调节葡萄糖稳态,促进产热
为确定P9对葡萄糖耐量和肥胖的影响是否通过GLP-1受体(GLP-1R)信号通路以及这些影响是否依赖于IL-6,该研究腹腔注射肠促胰岛素类似物(9-39)(GLP-1R拮抗剂)并将P9口服给HFD喂养小鼠,与单独注射P9的效果进行比较。有趣的是,肠促胰岛素类似物(9-39)处理抑制了P9对葡萄糖耐量、胰岛素耐量、体重增加和食物摄入的影响,这表明P9激活了GLP-1受体途径,并介导其对葡萄糖稳态和体重的影响。有趣的是,P9对葡萄糖稳态的影响在IL-6-敲除(KO)小鼠中被完全消除,这意味着IL-6对于P9诱导GLP-1分泌及其对葡萄糖稳态的影响至关重要。虽然单独使用P9诱导产热,但肠促胰岛素类似物(9-39)的共同注射与室温和冷休克后的直肠温度较低有关。此外,在IL-6-KO小鼠中没有观察到P9的这些影响,这表明GLP-1R信号传导和IL-6都参与iBAT激活和产热。P9处理的野生型(WT)小鼠中循环的GLP-1浓度大大增加,但IL-6-KO小鼠没有。有趣的是,在IL-6-KO小鼠中Icam2的mRNA表达较低,这表明正常的ICAM-2表达可能需要IL-6。
以前的研究集中在A. muciniphila的外膜上,并表征了79种蛋白质,这些蛋白质可能代表介导与宿主相互作用并具有代谢作用的候选物。比较A. muciniphila外膜的蛋白质与蛋白质组学分析CFS的蛋白质发现只有一种共同的蛋白质(Amuc_0576),这表明A. muciniphila分泌的蛋白质与外膜中存在的蛋白质不同。SNUG-61027和ATCC-BAA-835的9种蛋白的相似度为>98%,P9序列相似度为99.41%。为鉴定人类肠道微生物群中P9或功能相似的肽的同系物,该研究将整个人类肠道宏基因组(GenBank:PPYE01311095.1)与P9序列进行比较,发现99.78%的查询覆盖率和100%的序列相似性,表明该蛋白质也存在于人类肠道微生物群中。
讨论
参与GPCR信号传导的受体介导肠内分泌细胞分泌GLP-1。然而,ICAM-2(也称为CD102)主要被称为免疫细胞整合素,参与细胞屏障渗透所需的免疫细胞相互作用。该研究提出了ICAM-2的功能,即它充当P9的GPCR样信号分子,并介导肠内分泌细胞释放GLP-1。虽然SCFAs被称为GLP-1诱导剂并且作用于GPCR信号通路,但在该研究中,A. muciniphila产生的乙酸盐和丙酸盐不能像P9那样强烈地诱导GLP-1。这些结果表明,P9通过与SCFAs明显不同的信号级联作用于ICAM-2以诱导GLP-1。此外,该发现与细胞内Ca2+信号传导和CREB和PLC介导途径的激活介导葡萄糖诱导的GLP-1分泌的概念一致。进一步的研究必须确定ICAM-2如何激活GPCR样下游信号传导并诱导GLP-1分泌。
IL-6具有多种组织特异性作用,以旁分泌或内分泌方式实现。IL-6信号传导的肝脏破坏引起胰岛素抵抗,而BAT衍生的IL-6是BAT移植对葡萄糖稳态的影响所必需的。最近的研究表明,急性运动诱导的IL-6增加会延迟胃排空,从而减少人类餐后胰岛素分泌。根据先前的研究结果,A. muciniphila在人源性外周血单核细胞中诱导更高的IL-6表达,并且A. muciniphila衍生的细胞外囊泡以剂量依赖性方式诱导IL-6,这里A. muciniphila从肠道通过P9诱导IL-6分泌,这对代谢稳态具有有益作用。此外,P9由A. muciniphila产生,其代谢作用通过IL-6起作用。当GLP-1R或IL-6信号传导受到抑制时,宿主产热被阻止。这些结果表明,P9直接参与A. muciniphila对IL-6和GLP-1信号传导的影响。
尽管P9具有积极作用,但如果A. muciniphila不能在体内超过其他细菌,那么在HFD的恶劣生态竞争条件下维持P9可能具有挑战性。在人类中,GLP-1在2分钟内被主动降解,为了规避这一限制,许多研究都集中在开发合成的GLP-1激动剂上,这些激动剂对二肽基肽酶4抑制剂的降解具有抗性。目前,GLP-1受体激动剂被推荐作为二甲双胍的附加疗法,用于2型糖尿病患者,可用作不能耐受二甲双胍患者的单药治疗。然而,每日皮下注射 GLP-1 激动剂与一些不良反应有关,包括恶心、呕吐、腹泻和其他胃肠道症状。该研究发现口服P9在小鼠体内显著改善了葡萄糖稳态。目前正在研究该蛋白质的结构及其在潜在治疗用途方面的安全性。
结论
A. muciniphila 通过在棕色脂肪组织和全身诱导解偶联蛋白1增加高脂肪饮食(HFD)诱导的 C57BL/6J 小鼠的产热和胰高血糖素样肽1(GLP-1)的分泌。应用快速蛋白质液相色谱和液相色谱结合质谱分析鉴定出一种84 kDa蛋白质,命名为P9,它由A. muciniphila分泌。通过L细胞和喂食HFD的小鼠实验表明,单独纯化的P9足以诱导GLP-1分泌和棕色脂肪组织产热。使用配体-受体捕获分析发现P9与细胞间黏附分子2(ICAM-2)相互作用。白细胞介素6缺乏会消除P9在葡萄糖稳态中的作用并下调ICAM-2表达。总之,该研究结果表明,P9和ICAM-2之间的相互作用可以作为代谢疾病治疗的目标。
「文章仅供学术探讨,如需转载请注明出处。」
 yzh@akkpro.com
yzh@akkpro.com


