欢迎您访问爱非克(深圳)生物科技有限公司
关键词:AKK菌、AKK菌格林汁、肝损伤
非酒精性脂肪性肝病是当代医学领域的新挑战,近期内非酒精性脂肪性肝病对人类健康的危害仍将不断增加。
非酒精性脂肪性肝病除可直接导致失代偿期肝硬化、肝细胞癌和移植肝复发外,还可影响其他慢性肝病的进展,并参与2型糖尿病和动脉粥样硬化的发病。代谢综合征相关恶性肿瘤、动脉硬化性心脑血管疾病以及肝硬化为影响非酒精性脂肪性肝病患者生活质量和预期寿命的重要因素。
研究背景
全世界每年的死亡原因中有2-4%的人是肝病。非酒精性脂肪性肝病(NAFLD)是最常见的肝脏疾病,全球患病率为25%。它是晚期肝纤维化、肝细胞癌(HCC)和肝功能衰竭的主要原因。正常肝组织由5-10%的静止肝星状细胞(HSC)组成,它们是位于肝窦周间隙的非实质细胞。纤维化标志物的表达和细胞外基质(ECM)蛋白的过度积累导致HSC活化,进一步导致肝纤维化的发生。炎症通过相邻的库普弗细胞细胞分泌细胞因子在触发HSC激活中起重要作用。肠道微生物通过维持代谢和免疫稳态以及抵御病原体影响宿主的健康状况。肠道因肠-肝轴与肝脏之间存在双边联系。最近的证据表明,肠道微生物群组成的变化与各种肝病的许多病理状况有关。因此,调节肠道菌群组成可能是预防肝损伤的一种潜在方法。研究已揭示Akkermansia muciniphila(A. muciniphila)作为下一代有益微生物在喂食高脂肪饮食(HFD)的小鼠的代谢和免疫功能中的保护和调节作用。此外,源自肠道微生物群的细胞外囊泡(EVs)可以通过渗透到循环系统中传播到各个器官,并导致广泛的免疫反应。该研究课题组前期发现发现A. muciniphila及其EVs通过增加白色脂肪细胞中过氧化物酶体增殖物激活受体(PPAR)基因的mRNA水平并诱导结肠组织中的免疫止血,对HFD喂养的小鼠具有抗肥胖作用。此外,在2021年发现热灭活的A. muciniphila可以抑制HSC活化并诱导脂多糖(LPS)激活的LX-2细胞系中的HSC退化。因此,该研究旨在静止和LPS激活的LX-2细胞系中检查了HSC对活的和巴氏杀菌的A. muciniphila及其EVs的反应,此外还评估了活的和巴氏杀菌的A. muciniphila及其EVs在HFD/四氯化碳(CCl4)引起的肝损伤小鼠模型中的效果。
研究内容
细菌培养、巴氏杀菌和EVs提取
A. muciniphila MucT 菌株(ATCC BAA-835)培养后离心,用无菌厌氧PBS洗涤沉淀两次,用于进一步的共培养实验和小鼠实验。部分细菌悬浮液在70 °C下加热15分钟以制备巴氏杀菌细菌。细菌培养上清液进行超速离心提取 EVs。
LX-2活化和治疗
来自大肠杆菌0111:B4的脂多糖(LPS)以0.01 µg/ml的浓度使用6小时,激活LX-2细胞系。之后,未刺激的LX-2和LPS激活的细胞接种不同的感染复数(MOIs 1,10,100)的活的(Lam)、巴氏杀菌(Pam)的A. muciniphila和不同浓度(1,10,50 µg/ml)的EVs,在 37 °C的CO2培养箱中培养24小时。从LX-2细胞中提取总RNA进行qRT-PCR分析GAPDH作为参考基因。
动物实验
25只雄性野生型C57BL/6小鼠(8周龄)在12小时光照、22–23 °C和40%湿度条件下进行驯化,自由获取标准饮食(SD)和高压灭菌水。使用CCl4伴随高脂肪饮食诱导肝损伤,HFD 动物腹腔注射2 ml/kg体重的10% CCl4 橄榄油溶液,每周两次,持续4周。将小鼠随机分组(n = 5),健康对照(动物在没有干预的情况下接受SD)、载体(HFD/CCL4 + 200 µl 无菌 PBS)、Lam(HFD/CCL4 + 109 CFU/200 µl 活A. muciniphila),Pam(HFD/CCL4 + 109 CFU/200 µl 巴氏杀菌A. muciniphila ) 和 EVs(HFD/CCL4 + 50 µg 蛋白质/200 µl),通过每日口服管饲法给予4周。处理结束时,颈椎脱臼处死小鼠,收集肝脏和结肠组织用于组织病理学和组织学分析,在没有事先禁食的情况下采集血样进行血清转氨酶和肝细胞因子的测定。收集肝脏、结肠和白色脂肪组织进行qRT-PCR分析以评估靶基因的相对表达,rpl -19作为标准化基因。
研究结果
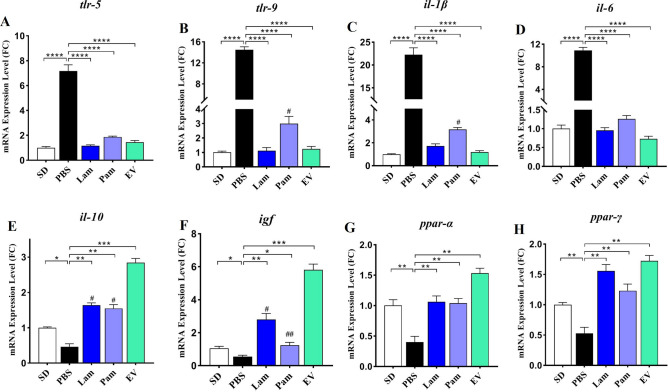
A. muciniphila减弱LPS激活的LX-2细胞中tlr -5和tlr -9的mRNA水平
为评估A. muciniphila及其衍生物对tlr -5和tlr -9基因mRNA水平的影响,该研究使用不同的MOIs(1、10和100)和 EVs浓度(1、10和50 µg)处理静止和LPS激活的LX-2细胞。结果发现,与未处理的对照细胞相比,活细胞和巴氏杀菌处理均未改变静止的LX-2细胞中tlr-5和tlr -9基因的表达,而50 µg的EV对tlr -5的表达具有抑制作用。在LPS刺激的LX-2细胞中,也仅有50 µg的EV可显著降低tlr -5基因的mRNA水平。在LPS激活的LX-2细胞中,所有浓度的EV都能显著下调tlr -9基因,而在MOI 1和MOI 10时的Lam以及MOI1处的Pam可以降低tlr -9基因的表达。因此,尽管所有处理对活化的LX-2细胞中tlr -5和tlr -9基因的mRNA水平都有抑制作用,但EVs的作用更为明显,对静止细胞几乎没有观察到显著影响。
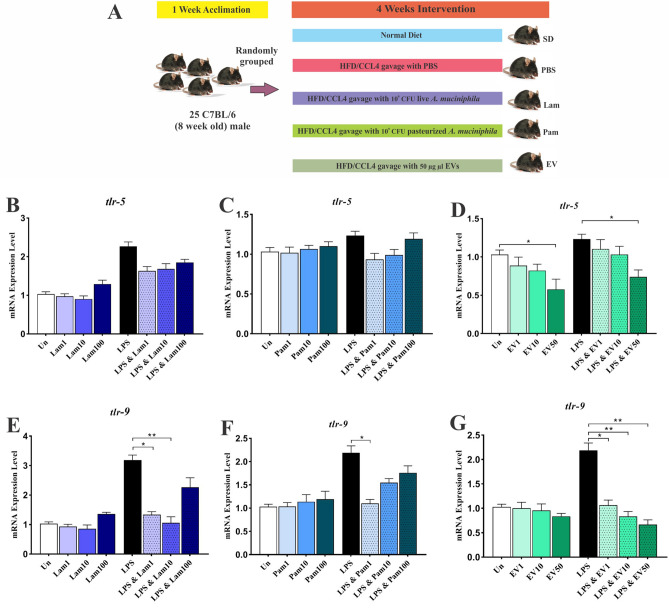
图上 动物实验的研究设计;LX-2细胞系中所有A. muciniphila补充剂的抗炎作用
图下 LX-2细胞系中所有A. muciniphila补充剂的抗炎作用
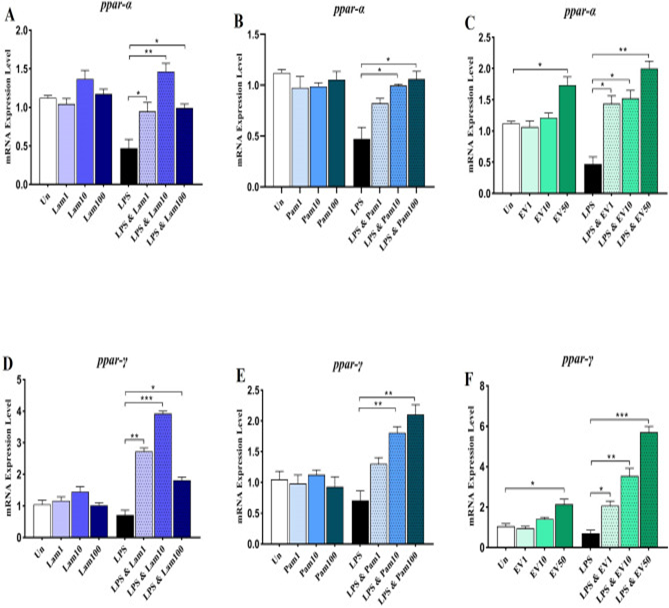
A. muciniphila显著上调LX-2细胞中的PPARs基因表达
该研究还在静止和LPS刺激的LX-2细胞中评估了活的和巴氏杀菌的A. muciniphila及其 EV对抗炎因子ppar-α和ppar-γ基因表达的影响。结果发现,在静止细胞中,用不同的活的和巴氏杀菌的细菌MOIs和EV浓度处理并没有显著改变ppar-α和ppar-γ基因的表达,而 50 µg的EV能够显著增加ppar-α和ppar-γ的mRNA水平。在LPS激活的细胞中,与未处理对照细胞相比,不同处理组的ppar-α基因的mRNA水平被显著诱导。其中,三种MOI和浓度下的Lam和EV以及MOI 10和100下的Pam对ppar-α基因的诱导有显著影响。然而,在LPS激活的LX-2细胞中,与未处理的对照细胞相比,不同处理显著诱导ppar-γ的mRNA 水平,其中细菌MOI 10和50 µg EV对ppar-γ基因的诱导有显著影响。因此,几乎所有治疗都能够诱导ppar-α和ppar-γ基因的表达,尽管在EV治疗中以剂量依赖性方式观察到最佳效果。
A. muciniphila及其衍生物可以通过调节炎症来维持肠道稳态
组织学分析显示,PBS组结肠黏膜有炎症细胞浸润(2级)。与SD组(16.7±0.37 μm)相比,PBS组(11.92±1.64 μm)上皮细胞厚度显著减少。PBS组黏膜层厚度(92.58±7.8 μm)明显低于SD组(119.95±1.97 μm)。Pam组黏膜层(161.45 ± 14.5 μm)和上皮(21.05 ± 1.25 μm)细胞厚度最大。此外,与PBS组相比,Lam和EV组的黏膜层和上皮细胞厚度显著增加。与PBS组相比,EV(119.9±3.1 µm)、Pam(148.9±1.8 µm)和Lam(135.1±3.2 µm)组的隐窝深度显著增加。与SD组(116.8 ± 1.6 µm)相比,Pam和Lam组的隐窝深度显著增加。与所有组相比,PBS组(86.9±1.6μm)的结肠隐窝深度显著降低。
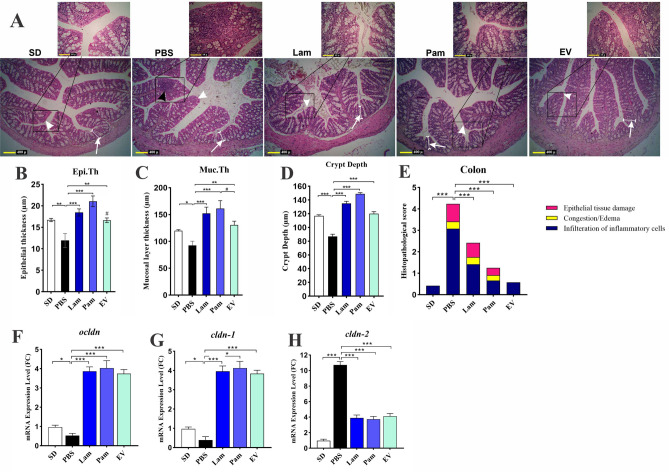
图上 不同研究组中结肠的组织学分析
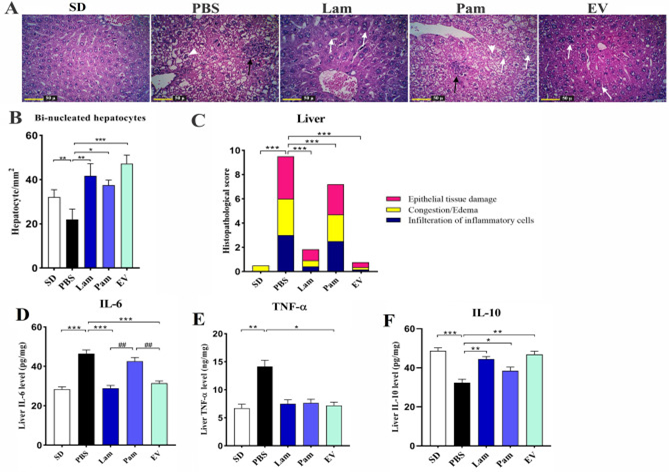
图下 活的和巴氏杀菌的A. muciniphila给药对不同研究组中肝脏的组织学分析
通过使用组织病理学评分系统对小鼠结肠组织损伤进行评分。各组总分如下:SD组,0.42 ± 0.22;PBS组,4.25±0.14;Lam组,2.42 ± 0.22;Pam组,1.25 ± 0.14和EV组,0.58 ± 0.08。组织病理学评分的统计分析显示PBS vs SD、Lam vs PBS、Pam vs PBS和EV vs PBS间有显著差异。这些观察结果伴随着用活的和巴氏杀菌的A. muciniphila及其EVs处理的小鼠结肠中紧密连接蛋白ocldn和cldn -1的mRNA水平显著增加,以及cldn -2的减少。尽管不同处理之间的黏膜层厚度存在显著差异,但它们诱导紧密连接蛋白基因的能力是相同的。
活A. muciniphila及其EVs对HFD/CCL4处理小鼠的肝组织具有抗炎作用
肝脏组织病理学分析证实,与SD组相比,PBS组建立了急性肝损伤。H&E染色显示,SD组未见组织病理学改变,而PBS组肝细胞的细胞质中可见炎性细胞浸润、点状坏死、肝细胞坏死以及脂质微泡和大泡。PBS组双核肝细胞数较SD组显著减少。此外,与SD组和PBS组相比,EV、Lam和Pam 组的双核肝细胞数量显著增加。双核肝细胞的存在表明肝细胞再生而没有任何其他组织病理学变化。在Pam组中,虽然在肝细胞的细胞质中观察到炎性细胞浸润、点状坏死、肝细胞坏死以及脂质微泡和大泡,但也观察到双核肝细胞的存在,表明肝细胞再生。此外,通过使用组织病理学评分系统对肝组织的组织学损伤评分,各组总分如下:SD组,0.5 ± 0.14;PBS组,9.5±0.28;Lam组,1.83 ± 0.16;Pam组,6.83 ± 0.44和EV组,0.75±0.13。组织病理学评分的统计分析显示PBS vs SD、Lam vs PBS、Pam vs PBS和 EV vs PBS间有显著差异,而EV vs SD之间没有观察到显著差异。
为研究活的和巴氏杀菌的A. muciniphila及其EVs的抗炎作用,该研究还评估了小鼠肝组织中TNF-α、IL-6和IL-10的水平。结果显示,与SD组相比,PBS组中IL-6、TNF-α和IL-10水平显著增加,表明炎症是在HFD/CCL4处理的小鼠肝组织中诱导。虽然用活的A. muciniphila灌胃可以降低TNF-α水平,但这种效果没有统计学意义,而施用EVs可以显著降低 TNF-α 的水平。此外,用活A. muciniphila及其EVs灌胃可显著降低IL-6水平,而巴氏杀菌处理组的IL-6水平与PBS组相比没有显著变化。巴氏杀菌的A. muciniphila对TNF-α细胞因子的影响也不显著,但显著提高了组织中IL-10的水平。尽管口服管饲所有治疗均可降低 IL-6和TNF-α的水平并增加IL-10,但这些抗炎作用在Lam和EV组中是显著的。
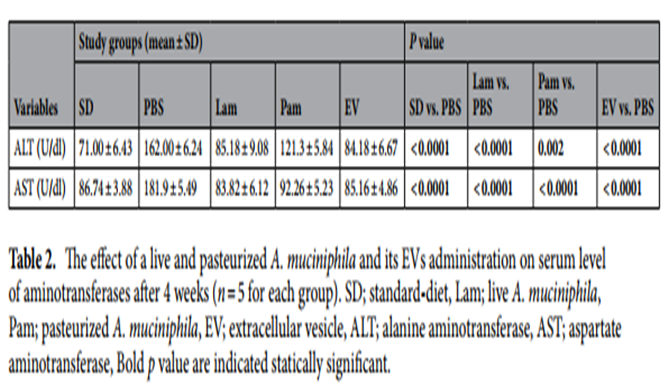
图上 活的和巴氏杀菌的A. muciniphila及其EVs给药对4周后血清转氨酶水平的影响
图下 肝脏炎症相关基因和抗炎相关基因的mRNA表达
此外,血清转氨酶水平的评估显示,与SD组相比,PBS组的ALT和AST水平显著升高,表明PBS组存在肝损伤。用 Lam、Pam和EVs进行口服管饲能够降低研究组中ALT、AST的水平。
A. muciniphila对HFD/CCL4处理小鼠肝组织中的炎症基因具有抑制作用
在HFD/CCL4小鼠模型的肝组织中,活的和巴氏杀菌的A. muciniphila及其EVs通过抑制TLRs和炎性细胞因子如il-1β、il-6和抗炎因子il-10的表达来表现其抗炎作用。HFD/CCL4显著升高tlr -5和tlr- 9的mRNA水平,进而导致PBS组中炎性细胞因子增加和il-10减少。与PBS组相比,给予Lam、Pam和EVs能够显著降低tlr-5和tlr-9基因的表达。这种细菌及其衍生物还通过降低il-1β和IL-6的表达并增加il-10来调节炎症和抗炎细胞因子从而诱导肝组织中的免疫稳态。有趣的是,各组间EV对诱导il-10和抑制il-1β的影响最大。
A. muciniphila通过上调PPARs基因表达对HFD/CCL4处理小鼠的肝组织具有抗炎作用
研究活的和巴氏杀菌的A. muciniphila及其EVs对肝组织中抗炎因子ppar-α、ppar-γ和igf 基因表达的影响。结果显示,在HFD/CCL4诱导肝损伤的PBS组中ppar-α、ppar-γ和igf表达显著降低。与PBS组相比,经口灌胃的处理能够显著诱导各组肝组织中这些抗炎因子ppar-α、ppar-γ和igf的mRNA水平,而EVs的效果比活的和巴氏杀菌的A. muciniphila更明显,尤其是igf 和ppar-α的水平。
EVs对HFD/CCL4处理的小鼠的白色脂肪组织具有显著的抗炎作用
为研究活的和巴氏杀菌的A. muciniphila及其EVs的抗炎作用,评估了小鼠脂肪组织中TNF-α、IL-6和IL-10的水平。结果显示,与SD组相比,PBS组观察到IL-6和TNF-α的水平显著增加,表明在脂肪组织中诱导了炎症。尽管口服管饲活的和巴氏杀菌的A. muciniphila可以降低IL-6,但这种效果没有统计学意义,而施用EVs可以显著降低IL-6的水平。用活的A. muciniphila及其EVs进行口服灌胃也降低了TNF-α并增加了IL-10的水平。巴氏杀菌A. muciniphila对TNF-α和IL-6的影响并不显著,但IL-10的水平发生显著变化。尽管所有治疗的口服管饲法均可降低IL-6和TNF-α的水平并增加IL-10,但这些抗炎作用在Lam和EV组中是显著的。
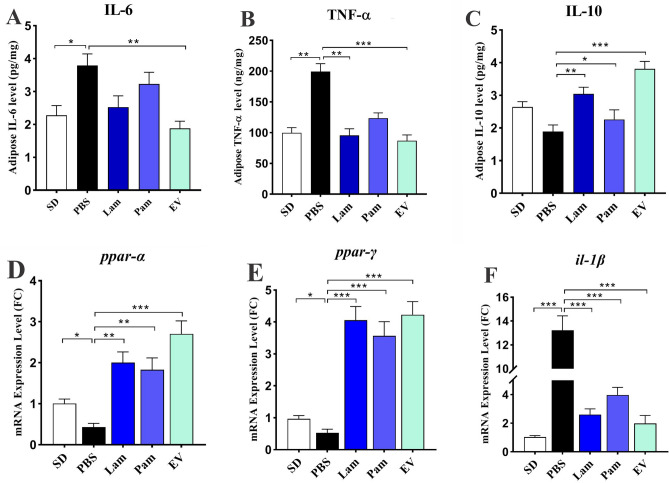
图 脂肪组织细胞因子水平和的脂肪组织 mRNA 水平
A. muciniphila及其EVs的抗炎作用伴随着小鼠白色脂肪组织中ppar-α和ppar-γ的mRNA 水平的增加以及il-1β的减少。尽管活的和巴氏杀菌的A. muciniphila能够增强ppar-α的表达,但EVs的效果更明显。所有处理均显著增加脂肪组织中ppar-γ和减少il-1β的表达,而HFD/CCL4显著下调PBS组中ppar-α和ppar-γ并上调的il-1β。
结论
施用活的和巴氏杀菌的AKK菌其EVs可改善HSC的激活。组织病理学分析显示,在所有治疗中通过增加上皮和粘膜层厚度以及加强肠道完整性,从而改善肠道健康。活的AKK菌及其EVs对肝脏炎症和肝细胞损伤具有抑制作用。组织细胞因子的产生和炎症基因表达水平表明,活的AKK菌其EVs对肝脏和脂肪组织具有更明显的抗炎作用。此外,EVs对调节与肝脏中TLR、PPAR和免疫反应相关的基因表达有更好的效果。总之,目前的结果表明,可以增强结肠、脂肪和肝组织的抗炎反应,从而预防 HFD/CCL4造成的小鼠肝损伤。然而,该研究存在一些局限性,未能确定从AKK菌中分离出的EV的含量,因此无法解释这些细菌衍生物在肝功能和肠道止血中的确切有益机制。需要进一步的研究来证实AKK菌的作用及其衍生物对预防人类肝损伤的作用,并探讨其潜在风险和不良反应。

「文章仅供学术探讨,如需转载请注明出处。」
 yzh@akkpro.com
yzh@akkpro.com


