欢迎您访问爱非克(深圳)生物科技有限公司
关键词:AKK菌、AKK菌格林汁、肝损伤
肝脏是腹腔内最大的实质性器官,也是人体最重要的代谢和解毒器官,担负人体的重要生理功能。
药物是肝损害的重要病因之一。对乙酰氨基酚是最常用的非处方止痛药,它存在于许多不同的药物产品中如感冒、流感片剂甚至是睡眠片剂,药店可以轻松购买到相关药品,可这并不意味着它是安全的。事实上,对乙酰氨基酚毒性是急性肝毒性的最常见原因。如果摄取太多,它会对身体造成严重的损伤。新的研究表明,如果多年使用,对乙酰氨基酚会增加患某些血癌的风险。
研究背景
对乙酰氨基酚(APAP)是临床常用的非甾体解热镇痛药。然而,过量的APAP具有很强的肝毒性,是全世界急性肝损伤的主要原因。在无毒代谢途径达到饱和后,过量的APAP经细胞色素P450(CYP)家族酶的催化生成细胞毒性化合物 N-乙酰基-对苯醌亚胺(NAPQI),并消耗肝脏中的谷胱甘肽(GSH)。当GSH耗尽时,肝细胞无法解毒NAPQI,剩余的NAPQI试图与线粒体蛋白结合,导致氧化应激和线粒体功能障碍,最终导致肝细胞坏死。肠道微生物群与其宿主保持共生关系。越来越多的研究报告了肠道微生物群与肝脏疾病之间的重要关联。通过促进胆汁酸循环、内毒素易位、通过Toll样受体调节Kupffer细胞、肠源性T细胞迁移等作用,微生物群失调与肝脏疾病如非酒精性脂肪性肝病(NAFLD)、自身免疫性肝病和肝硬化等密切相关。调节微生物结构已成为改善肝病预后的重要治疗方法。尽管有报道称微生物群介导APAP肝毒性,并且选定的物种可以防止药物引起的肝损伤,但微生物群对APAP诱导的肝损伤的影响及其机制的研究还不够充分。在动物研究中,只有少数益生菌被证实对APAP引起的肝损伤具有保肝作用。Akkermansia muciniphila被认为是一种非常有前途的益生菌,占人体肠道菌群的0.5%~5%,在促进免疫调节和代谢功能以及维持宿主的稳态条件方面具有代表性。A. muciniphila粘附在粘液层并消耗粘液聚糖寡糖作为营养物质。粘蛋白的降解代谢物,如短链脂肪酸(SCFAs),可以调节脂质代谢和免疫反应相关基因的表达。研究表明A. muciniphila给药显著改善了伴刀豆球蛋白A(ConA)模型中的免疫介导的肝损伤。该研究旨在探索A. muciniphila对APAP诱导的肝损伤的影响,并通过多组学整合,结合16S 测序、转录组学和代谢组学研究其潜在机制。
研究内容
无特定病原体(SPF)C57BL/6小鼠(雄性,6周)维持在SPF环境中。适应性喂养2周后,将小鼠随机分为四组(每组n=10):AkAP(A. muciniphila+APAP)、AkC(A. muciniphila+盐水对照)、NsAP(生理盐水+APAP)和NsC(生理盐水+生理盐水对照)。AkAP和AkC组的小鼠每天灌胃0.2 mL含3×109 CFU A. muciniphila Muc T(ATCC BAA-835)的无菌盐水,而NsAP和NsC组中的小鼠用等剂量的无菌盐水处理,处理持续14天。灌胃处理14天后在第15天建立APAP诱导的肝损伤模型。在禁食12小时后,AkAP和NsAP组的小鼠腹腔注射APAP(300 mg/kg生理盐水),而AkC和NsC组的小鼠给予等体积的生理盐水作为对照。腹腔注射后24 h收集各组小鼠新鲜粪便,然后处死。收集血液和肝组织进行生化参数分析;收集肝组织和结肠组织进行组织学和免疫组织化学分析;流式细胞术分析新鲜肝脏,TUNEL检测评估肝细胞的细胞凋亡;处死前收集的粪便用于16S rRNA测序,进行靶向粪便代谢组学分析;从储存的肝片段中提取总RNA进行转录组测序和RT-qPCR分析;对肝样品进行蛋白质印迹分析。所有小鼠饲养在环境温度和湿度控制条件下,自动12小时明暗循环,并随意提供食物和水。
研究结果
A. muciniphila改善APAP诱导的肝损伤
300 mg/kg APAP给药后24 h建立小鼠急性肝损伤模型。作为肝功能的典型生物学标志物,测定血清丙氨酸氨基转移酶(ALT)和天冬氨酸转氨酶(AST)水平以评估肝损伤的严重程度。腹腔注射APAP后ALT和AST水平显著升高。此外,与生理盐水+APAP(NsAP)处理组相比,A. muciniphila(AkAP)的给药显著降低了ALT和AST水平。苏木精和伊红(H&E)染色分析显示NsAP组有广泛坏死和大量炎性细胞浸润的迹象,A. muciniphila+APAP(AkAP)治疗组中仅观察到零星的小坏死灶和相对较低的炎性细胞浸润。A. muciniphila+生理盐水(AkC)对照组和生理盐水+生理盐水(NsC)对照组中未检测到明显的病理结果。改良组织学活性指数(HAI)与ALT和AST水平的变化呈现出相似的趋势:与NsC相比,NsAP的HAI评分显著增加,并且在A. muciniphila给药后部分恢复。综上所述,上述结果表明A. muciniphila有效地减轻了APAP诱导的肝损伤。
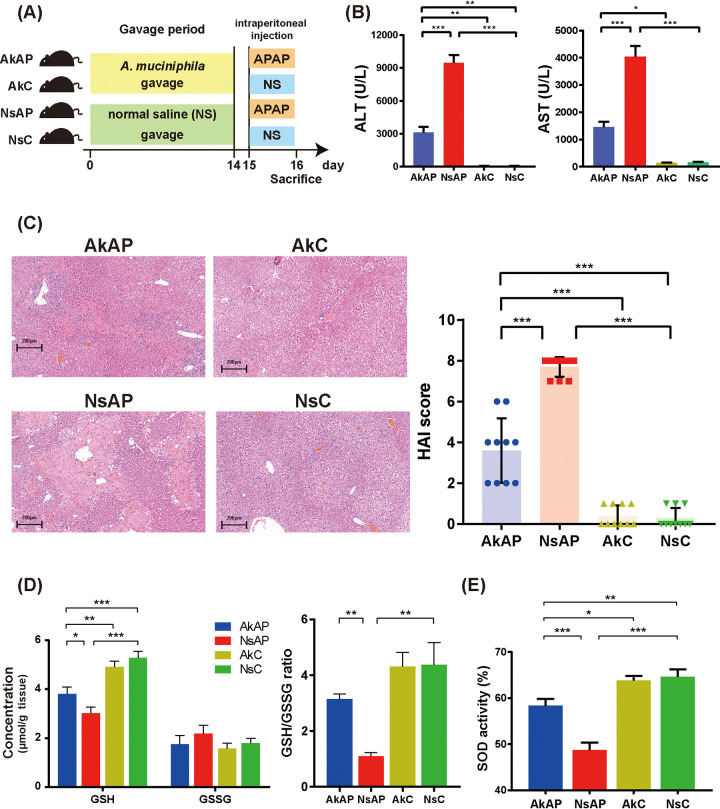
图上 A. muciniphila的给药改善APAP诱导的肝损伤和氧化应激
图下 A. muciniphila改善APAP诱导的氧化应激和肝脏炎症反应
A. muciniphila减轻APAP诱导的氧化应激和炎症反应
由细胞内GSH耗竭引起的线粒体通透性增加和氧化应激被认为是APAP诱导的退化的初始但关键触发因素。该研究测定GSH、氧化型谷胱甘肽(GSSG)和超氧化物歧化酶(SOD)的水平以评估对氧化应激的脆弱性。APAP处理后24小时,GSH、GSH/GSSG和SOD水平显著降低。然而,与NsAP相比,AkAP组显示出这些指标的明显恢复。此外,四组间的GSSG水平无显著差异。
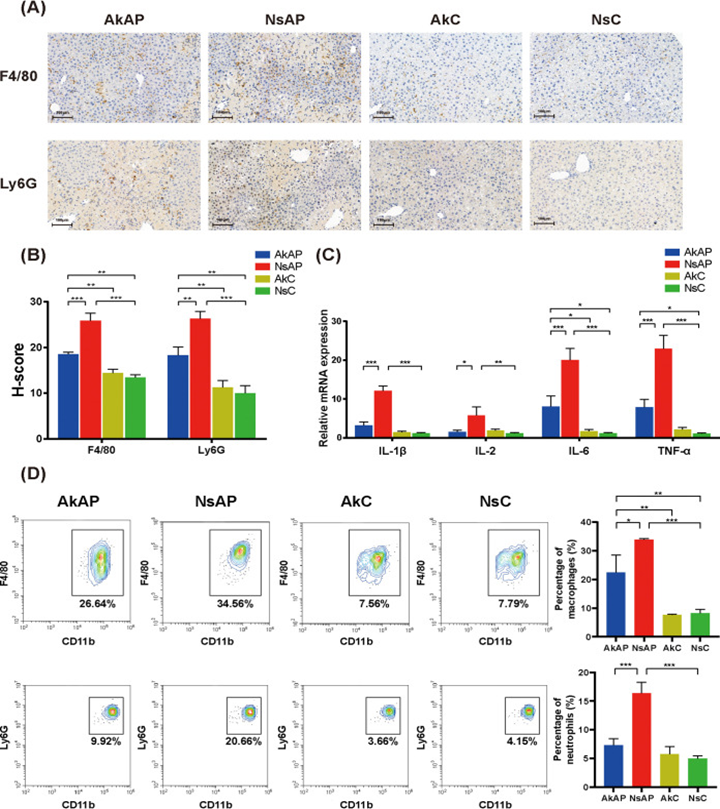
由活化的Kupffer细胞和浸润的免疫细胞介导的炎症反应在APAP毒性级联发展中起着至关重要的作用。为评估肝脏炎症,该研究在转录水平检测了代表性炎症标志物(IL-1β、IL-2、IL-6、IL-10、TNF-α和IFN-γ)的表达变化。NsAP组小鼠的IL-1β、IL-2、IL-6和TNF-α表达明显低于NsC小鼠,表明APAP导致肝脏炎症反应。然而,与NsAP相比,AkAP中A. muciniphila给药后这些细胞因子下调表明炎症减轻。此外,用抗F4/80或抗Ly6G进行免疫组织化学分析以估计巨噬细胞和中性粒细胞的肝浸润。染色结果表明APAP显著促进巨噬细胞和中性粒细胞的募集,而A. muciniphila给药明显减少巨噬细胞和中性粒细胞浸润。流式细胞术分析还证实,与NsC相比,AkAP中巨噬细胞和中性粒细胞的积累增加;而与NsAP相比,AkAP的巨噬细胞和中性粒细胞数量较少。此外还观察到其他免疫细胞亚群(CD4 + T细胞、CD8 + T细胞、B细胞、NK细胞、NKT细胞)没有显著变化。这些结果表明A. muciniphila改善了APAP肝毒性诱导的氧化应激和肝脏炎症反应。
A. muciniphila在APAP攻击期间调节肝脏转录表达的改变
为进一步研究A. muciniphila如何有助于保护肝脏免受APAP引起的损伤,该研究对从AkAP、NsAP和NsC(每组n=4)采集的肝脏进行转录组分析。在NsAP vs NsC比较组中,通过使用P < 0.05和| log 2(fold change)| > 1标准鉴定出2810个差异表达基因(DEGs)。在这些DEGs中,与NsC相比,NsAP中分别有1558和1,252个显著上调和下调。在AkAP vs NsAP比较组中,838和846个DEGs在NsAP中分别显著上调和下调。NsAP和 NsC具有明显不同的基因表达模式,而AkAP和NsC的聚类模式相对相似和同质,表明病理过程的改善。通过对来自两个转录组比较的所有DEGs进行重叠分析,确定了777个由APAP注射促进但被A. muciniphila给药抑制的DEGs和711个由APAP注射抑制但由A. muciniphila给药促进的DEGs,表明A. muciniphila显著调节了由APAP引起的转录改变。对来自NsAP vs NsC比较组的DEGs进行基于adj-P <0.05的京都基因和基因组百科全书(KEGG)富集分析揭示了73条途径。受影响的途径主要分配给药物代谢,涉及CYP、UGT、SULT和谷胱甘肽S -转移酶(GST)家族。KEGG富集分析AkAP vs NsAP比较组确定了50种途径,例如类固醇激素生物合成、细胞色素P450对异生素的代谢和细胞因子-细胞因子受体相互作用。通过映射来自这50条重要途径的基因来构建蛋白质-蛋白质相互作用(PPI)网络,以对参与肝保护的基因进行分类。从PPI网络中提取了四个主要簇,分别代表药物代谢、炎症、氨基酸生物合成和信号传导。值得注意的是,磷脂酰肌醇3-激酶(PI3K)/Akt)途径被确定为第4组中最丰富的途径。这些结果表明A. muciniphila的保护可归因于与代谢、炎症和信号相关的转录表达的调节转导。
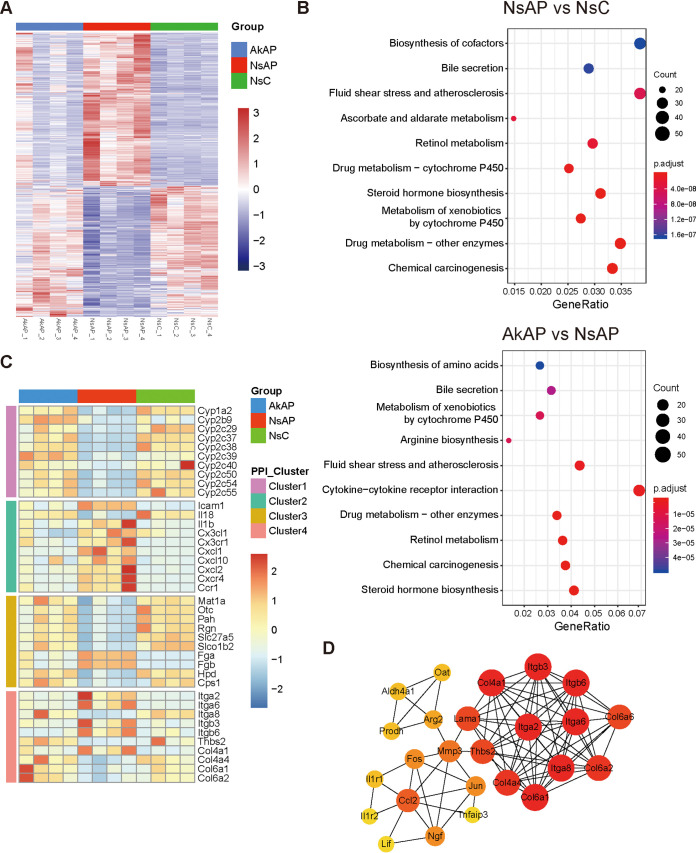
图上 A. muciniphila干预影响肝脏转录组的改变
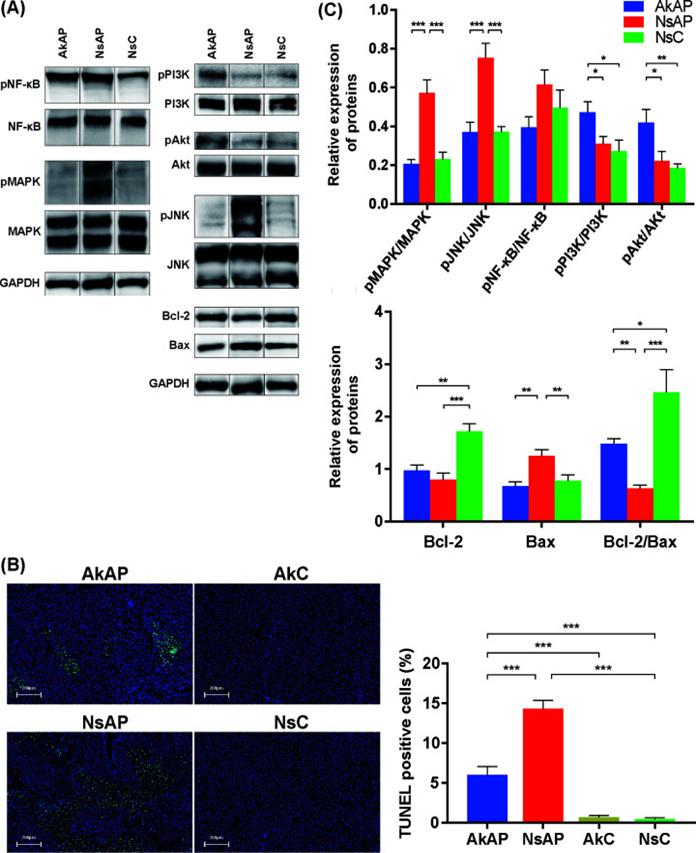
图下 A. muciniphila干预抑制APAP诱导的细胞凋亡并激活PI3K/Akt信号通路
A. muciniphila激活PI3K/Akt通路并抑制肝脏中的细胞凋亡
转录组学结果表明,PI3K/Akt通路可能是导致A. muciniphila在APAP攻击下的作用的原因。激活的PI3K/Akt通路通过调节Bcl-2和Bax来抑制细胞凋亡。APAP处理对Akt和PI3K磷酸化没有影响,但A. muciniphila在APAP攻击后促进了Akt和PI3K的磷酸化。Bax在NsAP组中的蛋白表达明显高于AkAP和NsC组,AkAP组中Bcl-2的表达明显高于NsAP,与NsC相比没有明显变化。作为细胞凋亡的重要指标,Bcl-2/Bax比值在NsAP中降低,而A. muciniphila倾向于将这种变化逆转为在NsC中观察到的水平。c-Jun N-末端激酶(JNK)和下游蛋白的激活是放大线粒体功能障碍和触发细胞凋亡的关键介质。该研究还发现A. muciniphila阻止了APAP引起的ERK1/2和JNK磷酸化水平的增强,而对NF-κB的磷酸化水平没有显著影响。与这些发现一致,末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)测定表明,与NsAP相比,AkAP中TUNEL阳性肝细胞的百分比降低,表明A. muciniphila减少了由APAP肝毒性引起的核DNA片段化。因此,A. muciniphila促进了PI3K/Akt通路的激活,纠正了Bcl-2/Bax比率,进一步抑制了肝细胞凋亡。
A. muciniphila增强肠道屏障功能并抑制LPS刺激
肠道屏障完整性的破坏是APAP中毒的肝外特征。该研究结果表明,在NsAP中血清脂多糖(LPS)水平升高,而在AkAP中由APAP毒性引起的LPS水平升高明显减轻。LPS被肝脏中的TLR4识别并触发MyD88依赖性炎症。肝脏中TLR4和MyD88的mRNA表达被APAP显著激活,并被A. muciniphila有效抑制至正常水平,表明APAP介导的LPS泄漏和细菌易位受到限制。此外,评估几种典型的肠道屏障因子(Occludin、Claudin、MUC2、ZO-1、大麻素受体1和大麻素受体2)的mRNA和蛋白质表达水平发现,与NsC相比,NsAP中Occludin和MUC2的mRNA表达分别下调45.8%和50.3%,并且A. muciniphila将Occludin和MUC2 mRNA表达增强至正常水平。仅在NsAP和AkC之间观察到Occludin蛋白表达的显著差异。MUC2蛋白表达遵循与mRNA表达相似的模式。NsAP和NsC之间的比较表明,APAP显著降低了Claudin蛋白水平。与NsAP相比,AkAP显示出恢复的Claudin蛋白水平。APAP没有诱导Claudin mRNA表达减少,但A. muciniphila仍然发挥刺激作用。这些组之间的大麻素受体1、大麻素受体2和ZO-1水平没有显著差异。
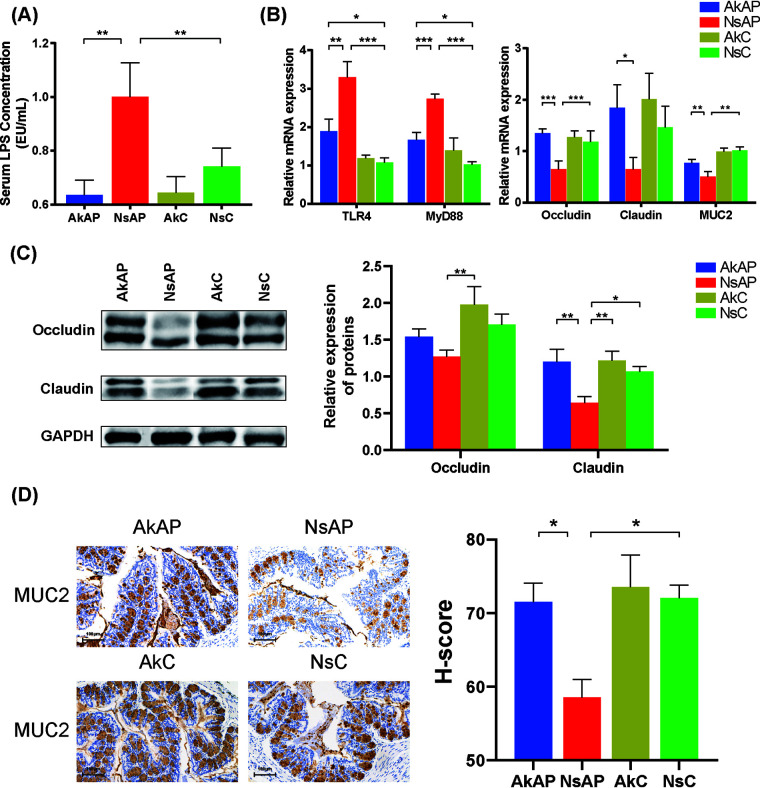
图左 A. muciniphila增强肠道屏障功能
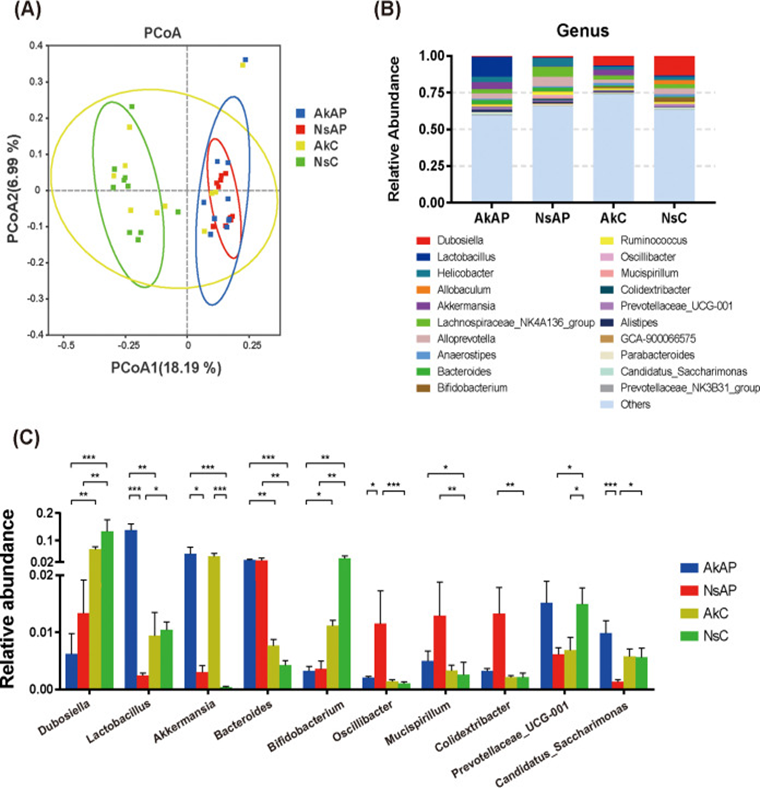
图右 A. muciniphila对APAP处理后微生物分类丰度变化的调节作用
A. muciniphila调节APAP诱导的肠道生态失调
为进一步揭示APAP过量对肠道稳态的肝外影响,该研究进行了16S rRNA测序分析,以探索APAP攻击期间肠道微生物群组成的改变以及A. muciniphila给药对微生物群落结构的影响。在APAP处理后,Chao1和香农指数显示α多样性增加。粪便样本根据微生物区系的相似性进行聚类,并通过未加权的UniFrac主坐标分析(PCoA)说明,AkAP和NsAP的微生物组谱与NsC的微生物组谱明显分开。微生物组的分类丰度发生了巨大变化。在门水平上,在灌胃A. muciniphila后,疣微菌门在AkAP和AkC中积累。APAP注射后,脱铁杆菌门、蓝细菌门和脱硫杆菌门的相对丰度显著增加。在使用或不使用A. muciniphila的APAP处理后,放线菌门的富集显著降低。与NsAP相比,AkAP中脱硫杆菌的相对丰度下降。在属水平上,与NsC相比在NsAP中观察到高比例的拟杆菌属、颤杆菌属、粘螺菌属和大肠杆菌,杜氏乳杆菌属、乳酸杆菌属、双歧杆菌属、普雷沃氏菌科UCG-001属和Candidatus_Saccharimonas属的比例降低。与NsAP相比AkAP中的乳酸杆菌和Candidatus_Saccharimonas属显著富集,而颤杆菌属显著耗尽。AkAP小鼠的乳酸杆菌属丰度明显高于AkC小鼠。接下来在AkAP、NsAP和NsC之间进行了线性判别分析(LDA)效应大小(LEfSe)分析,以确认微生物群结构的改变并确定特征分类标记。根据NsAP和NsC的比较,APAP处理后颤杆菌属、Mucispirillum属、Colidextribacter属和拟杆菌属富集,并去除了杜氏乳杆菌属、双歧杆菌属、Allobaculus属、普雷沃氏菌科UCG-001属和乳酸杆菌属。AkAP和NsAP的比较表明,AkAP组中乳酸杆菌、Candidatus_Saccharimonas属和Akkermansia属富集,而NsAP组中颤杆菌属、 Colidextribacter属、Pseudaminobacter属、瘤胃梭菌属和Idiomarina属富集。
A. muciniphila重塑的微生物群恢复了SCFA的产生
短链脂肪酸仅由宿主微生物发酵产生,被认为是肝-肠轴中不可或缺的信号。因此,该研究进行了靶向代谢组学分析以确定粪便中特定SCFAs(乙酸、丙酸、2-甲基丙酸、丁酸、2-甲基丁酸和戊酸)的浓度。与NsC相比,AkC组在乙酸、丁酸和2-甲基丁酸的水平上表现出一致的增强,表明A. muciniphila引发了SCFA的产生。APAP注射与A. muciniphila给药后,乙酸、丙酸和丁酸的浓度显著降低,表明APAP突然降低了SCFA的产生。A. muciniphila增加了这些SCFAs的水平,尽管恢复的水平仍然低于NsC和AkC中的水平。APAP处理的小鼠显示2-甲基丁酸和戊酸升高,但差异不显著。即便如此,在APAP注射后A. muciniphila仍然导致这些SCFAs的浓度增加至常规水平。
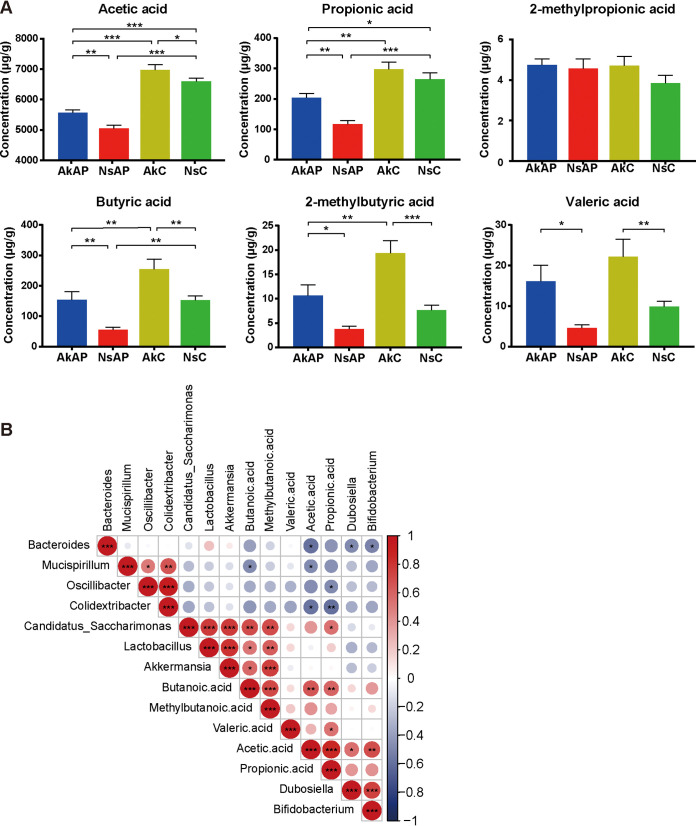
图上 A. muciniphila在APAP攻击后提高了SCFA的产量
图下 肠道微生物群、微生物代谢和APAP诱导的病理变化之间的相互作用
差异丰富的微生物属和代表性生物标志物的相关性
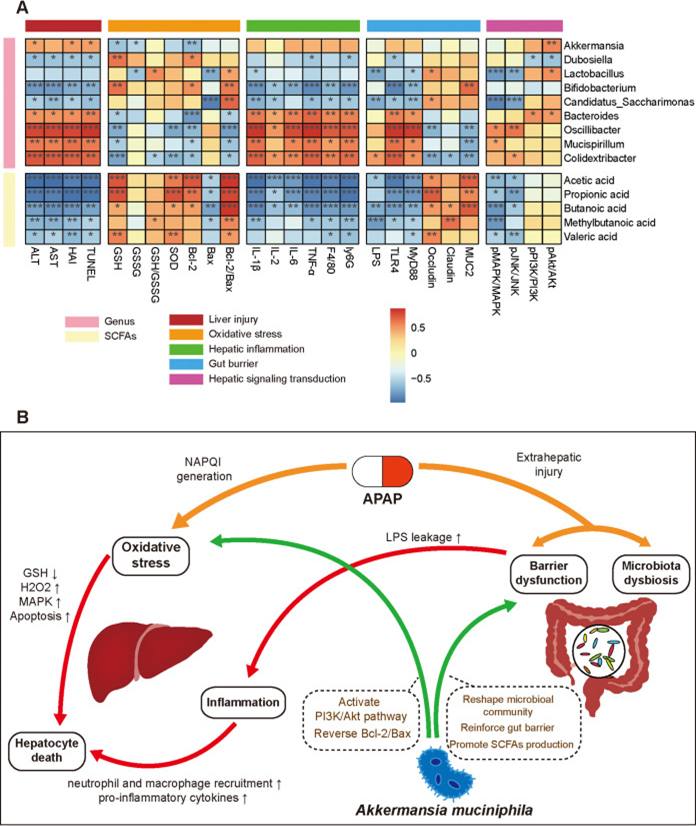
此外,该研究进行涉及差异属、SCFAs和损伤指标的相关性分析,以确定改变的肠道属和生物标志物之间的假定关联。差异丰度微生物属与SCFAs的相关性分析表明,在Akkermansia管理下,乳酸杆菌属和Candidatus_Saccharimonas属是保守的,它们的相对丰度与 Akkermansia的相对丰度呈正相关。在颤杆菌属、Mucispirillum属和Colidextribacter属之间发现了相应的正相关,因为这些属被认为是不利的属并且在NsAP组中富集。乙酸与杜氏乳杆菌属和双歧杆菌属呈正相关,与拟杆菌属、Mucispirillum属和Colidextribacter属呈负相关。丙酸与Candidatus_Saccharimonas属呈正相关,与颤杆菌属和Colidextribacter属呈负相关。丁酸和2-甲基丁酸与Akkermansia属、乳酸杆菌属和Candidatus_Saccharimonas属呈正相关。
益生菌可能会加重APAP引起的肝损伤的严重程度。NsAP中含量丰富的颤杆菌属、Mucispirillum属和Colidextribacter属与肝损伤指数(ALT、AST、HAI和TUNEL阳性率)和炎症因子(细胞因子和炎症细胞浸润)呈正相关。相比之下,乳酸杆菌属、Candidatus_Saccharimonas属和SCFAs通常与肝损伤指数、炎症因子、血清LPS水平和JNK磷酸化呈负相关。此外,抗氧化能力(Bcl-2/Bax比值和SOD活性)与乳酸杆菌、Candidatus_Saccharimonas属、双歧杆菌和SCFAs呈正相关。Akt磷酸化水平与Akkermansia属、乳酸杆菌属和拟杆菌属呈正相关。基于综合分析,该研究揭示了A. muciniphila重塑的微生物群落、微生物代谢功能和A. muciniphila的肝保护作用之间的本质相互作用。
结论
肠道微生物群驱动个体对过量对乙酰氨基酚(APAP)介导的肝毒性的敏感性。在该项研究中,AKK菌的提升有效地减轻了APAP诱导的肝毒性,并降低了血清丙氨酸氨基转移酶(ALT)和天冬氨酸转氨酶(AST)的水平。AKK菌显著减弱APAP诱导的氧化应激和炎症反应,这可以通过恢复还原型谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)平衡、增强超氧化物歧化酶(SOD)活性、减少促炎细胞因子产生以及减轻巨噬细胞和中性粒细胞浸润来证明。此外,AKK菌维持肠道屏障功能,重塑受干扰的微生物群落并促进短链脂肪酸(SCFA)分泌。AKK菌的有益作用伴随着转录水平肝脏基因表达的改变和磷脂酰肌醇3-激酶(PI3K)/Akt信号通路的激活。该结果表明AKK菌可能是APAP诱导的肝损伤的潜在预处理。

「文章仅供学术探讨,如需转载请注明出处。」
 yzh@akkpro.com
yzh@akkpro.com


