欢迎您访问爱非克(深圳)生物科技有限公司
关键词:AKK菌、AKK菌格林汁
全球肥胖人口在过去20年里急速增长,中国肥胖人口于2016年已赶超美国,成为全球第一。许多数据表明,传统减重的复胖率达90%以上,超重和肥胖者需要更加科学的干预手段。

代谢失调是一种影响人类(或动物)细胞生产能量的障碍,又称为新陈代谢失调症。代谢失调易引起肥胖、高血糖、高血脂等代谢类疾病,而超重和肥胖已经成为全球死亡率和慢性病病发率持续增高的重要因素之一,并且大大提高了成年人心血管疾病和癌症的风险。与肥胖相关联的疾病数不胜数,“胖死”绝非空穴来风,目前因肥胖所引起的疾病有五大类,其中三种都有致死的风险。
研究背景
代谢失调代表一组代谢异常,例如高血糖、高胰岛素血症和高脂血症。它是肥胖相关疾病的重要衡量标准,也被认为是肥胖的关键并发症。慢性肥胖会在很长一段时间内发展,并可能引发特定的代谢异常,例如促炎性疾病、血脂异常、高血压、胰岛素抵抗、葡萄糖耐受不良、非酒精性脂肪肝病(NAFLD)、2型糖尿病和某些类型的癌症。因此,肥胖的预防和治疗似乎是世界范围内的主要治疗问题。肥胖的主要驱动因素是能量摄入和能量消耗之间的不平衡,其中过度食用高脂肪饮食(HFD)是导致代谢紊乱的主要因素之一。目前的证据强调肠道微生物群落与宿主健康和疾病的密切关联。肠道微生物群与宿主代谢之间的相互作用是由许多因素介导的,包括由肠道屏障缺陷引起的炎症以及短链脂肪酸和胆汁酸的代谢。肠道微生物群落失衡(生态失调)与肥胖和代谢紊乱(如2型糖尿病)相关的临床表现有关。通过基于微生物组的治疗,如益生菌、益生元、粪便微生物群移植(FMT)、代谢手术和药物来调节肠道微生物群,可能是预防和治疗代谢综合征的有效靶向治疗策略。粘蛋白降解细菌Akkermansia muciniphila ( A. muciniphila )是人体肠道中最丰富的单一物种之一(占细菌总数的0.5-5%),是一种很有前途的益生菌候选物。几项研究表明A. muciniphila在维持肠道健康和葡萄糖稳态以及预防和改善炎症、代谢紊乱、肥胖和相关并发症方面的有益影响。但活益生菌的治疗用途的安全性仍然是一个值得关注的问题。热灭活的益生菌微生物群在体外、动物模型和临床研究中保留了其关键的有利特性和有益效果。因此,这些被杀死或经过巴氏杀菌的细菌可能比活益生菌更有安全性的优势。新出现的证据表明,益生菌对宿主的影响程度在细菌的活体和热灭活形式之间存在差异。这促使该研究使用HFD诱导的小鼠模型比较了活的和巴氏杀菌的A. muciniphila对肥胖、代谢失调、相关炎症损伤和肠道屏障完整性的效果。
研究内容
63只雄性C57BL6/N小鼠(6周龄,20 ± 1 g)放入笼子中(3只动物/笼子)并在25°C、50-60%湿度和暴露于12小时光照/12小时黑暗的循环中适应1周,并随意获取正常饮食和饮水。正常饮食由20%的蛋白质、64%的碳水化合物和7%的脂肪组成(总热量,4 kcal/g,16%的热量来自脂肪);HFD的配方含有26%的蛋白质、26%的碳水化合物和48%的脂肪(总热量,5.24 kcal/g,60%的热量来自脂肪)。将所有小鼠称重并随机分为七组(n=9):(1)正常,可自由获得正常饮食和饮水;(2)HFD,自由获取HFD和水;(3)Xen,自由获得HFD和水,并用抗肥胖药物奥利司他(Xen®, Roche, Milano, Italy)治疗;(4)L.B,自由获取HFD 和水,用活的A. muciniphila BAA-835型菌株的冻干形式处理;(5)P.B,自由获取HFD 和水,用巴氏杀菌的A. muciniphila BAA-835型菌株的冻干形式处理;(6) L.A,自由获取HFD和水,用活的A. muciniphila EB-AMDK19菌株(先前研究从健康的韩国受试者中分离,基因组特征登录号NZ_CP025834)的冻干形式处理;(7)P.A,自由获取HFD和水,用巴氏杀菌的A. muciniphila EB-AMDK19菌株的冻干形式处理。细菌样品用无菌PBS作为溶剂以1×108 CFU/动物经口管饲法施用于动物组。Xen®溶解在PBS中以10 mg/kg的剂量口服给药于Xen组。正常组和HFD组的小鼠口服PBS作为溶剂,而不是细菌或Xen®。在为期12周的研究期间,每周进行5次上述药物和溶剂的处理。每周测量小鼠的体重,并在研究期的最后一天处死之前作为最终体重。
A. muciniphila对HFD喂养小鼠的身体、器官和脂肪重量的影响
在第12周研究结束时,HFD组的一周后每周体重和体重增加、肝脏重量以及附睾脂肪、内脏脂肪和总脂肪的重量、第12周的血清TC水平显著高于正常组。有趣的是,P.B、L.B、P.A和L.A处理的HFD喂养小鼠,而不是Xen处理,导致第12周的体重增加显著下降。用上述所有测试剂处理HFD喂养小鼠12周也导致肝脏重量、附睾脂肪和内脏脂肪的重量显著降低。相反,在仅用Xen和PB处理12周后,在HFD喂养小鼠中观察到总脂肪和血清TC水平显著降低。
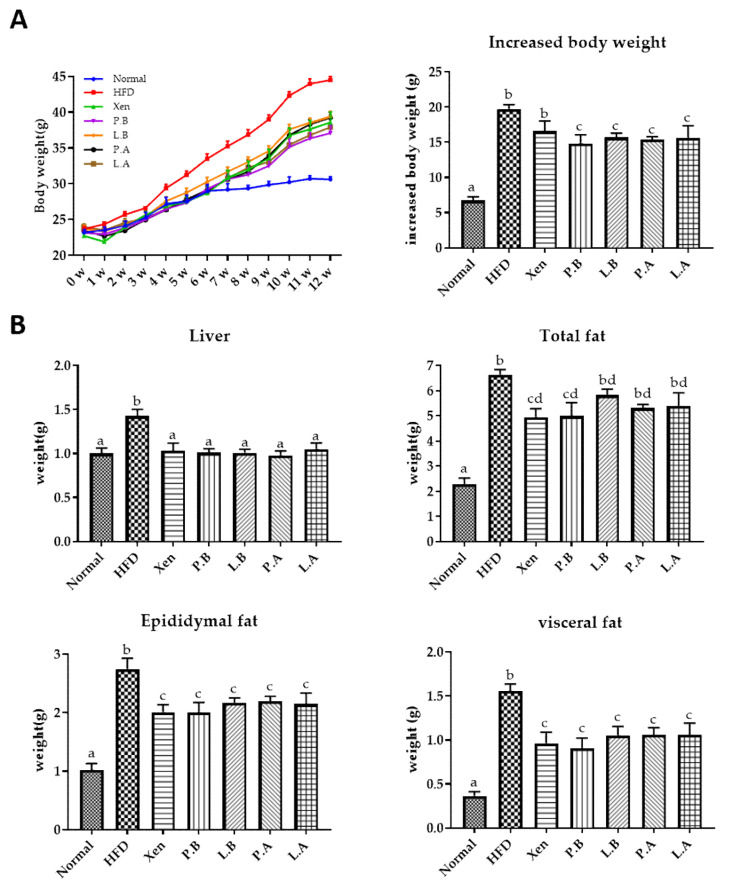
图上 A. muciniphila对HFD喂养小鼠的身体、器官和脂肪重量的影响
图下 A. muciniphila菌株的口服给药改善高脂饮食诱导的小鼠的肥胖参数
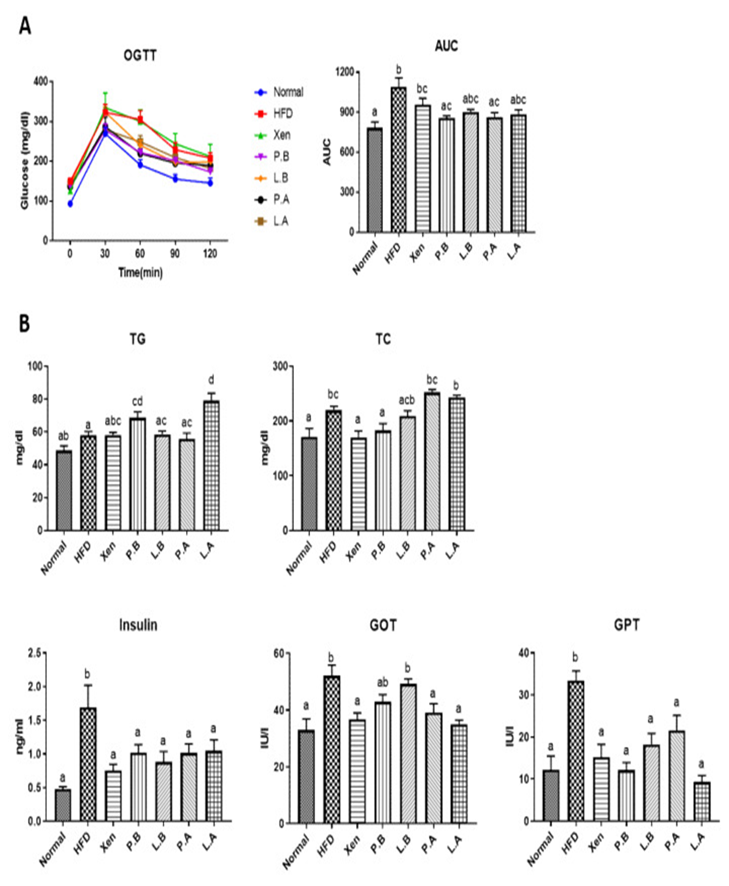
A. muciniphila改善HFD组的胰岛素敏感性和葡萄糖稳态
OGTT结果显示,在每个测量时间点(0、30、60、90和120 min),HFD组的血糖水平明显高于正常组。另一方面,通过P.B、L.B、P.A和L.A处理,HFD喂养小鼠的葡萄糖清除率有所提高,但程度不同。该研究结果进一步表明,当暴露于PB和PA时,HFD喂养小鼠的血清葡萄糖AUC显著降低,而其他治疗则没有。喂养HFD也导致血清胰岛素水平显著增加但没有对GLP-1的肠道基因表达产生任何显著变化。特别是,用所有上述测试剂对HFD喂养小鼠进行处理会导致血清胰岛素水平显著降低。
A. muciniphila在HFD诱导的小鼠中改善肝脏脂肪堆积、脂肪变性、炎症和肝损伤
正如预期的那样,正常组肝脏的H&E和油红O染色显示出正常的组织学结构,其特征是大空泡的外观可忽略不计和脂质沉积最少。HFD喂养小鼠表现出异常的肝脏组织学特征,主要是与显著脂质积累相关的大量液泡,这是肝脏脂肪变性的特征。这与HFD组的肝脏重量明显高于正常组一致。与正常组相比,HFD组肝脏中脂肪生成标志物SREBP-1c、ACC和FAS的基因表达显著升高也证实这些发现。此外,这些结果还表明,HFD喂养对肝脏造成炎症损伤,这可以通过HFD组肝脏中促炎趋化因子MCP1和促炎细胞因子IL-1b、IL-6和IL-17的基因表达显著高于正常组来证明。与HFD的上述不良反应一致,HFD的肝毒性影响表现为HFD组血清GOT和GPT水平显著高于正常组。
用所有测试剂对HFD喂养小鼠进行处理,可防止脂滴在肝脏中的积聚,并导致肝脏组织学特征的显著改善,使组织结构恢复到几乎正常的状态。与这些一致,HFD组肝脏中脂肪生成标志物的基因表达也被测试剂抑制,但选择性地抑制如下:Xen、P.A和L.A抑制SREBP-1c的基因表达;P.A和L.A抑制ACC的基因表达;Xen、P.B和L.B抑制FAS的基因表达。测试剂还显示出肝脏抗炎活性,即它们下调HFD喂养小鼠肝脏中炎症介质基因表达的能力,但程度不同:所有处理下调IL-6基因表达;所有处理的下调MCP1和IL-1b基因表达,PA除外;L.B、P.A和L.A下调IL-17基因表达。测试剂对HFD诱导的小鼠肝毒性具有保护作用,这些测试剂可降低血清GOT和GPT水平,但程度不同。特别是在HFD喂养小鼠中,所有测试剂处理后血清GPT水平显著降低,而Xen、P.A和L.A处理后血清GOT浓度显著降低,但P.B和L.B处理没有。
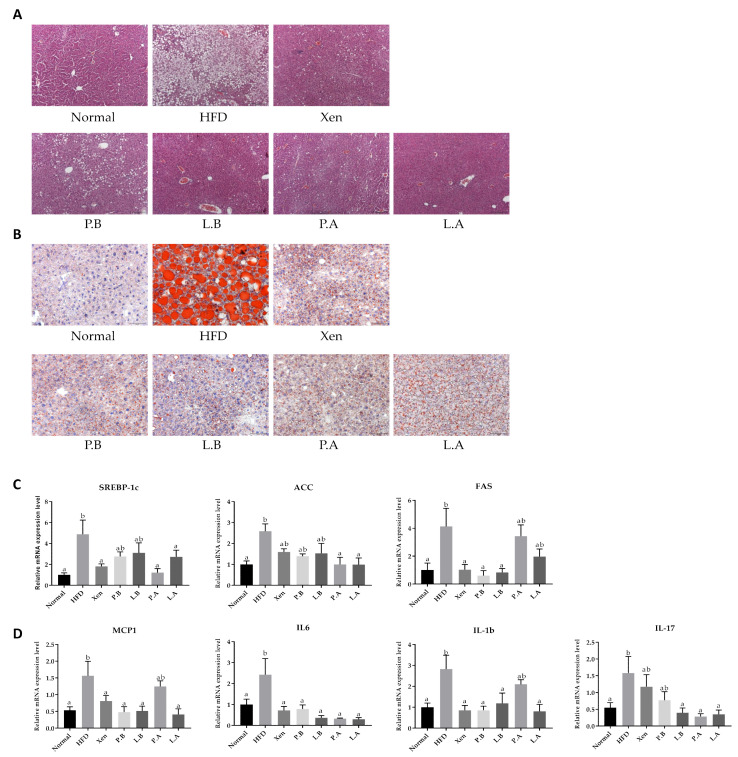

图上 A. muciniphila菌株的口服给药可抑制高脂饮食诱导的小鼠肝脏中的脂肪变性、脂肪生成和炎症
图下 细菌对HFD小鼠脂肪组织的影响
A. muciniphila抑制脂肪组织中的脂肪生成和炎症
附睾脂肪组织的H&E染色显示,HFD组脂肪细胞的平均直径和面积显著高于正常组,表明 HFD喂养的动物有明显的脂肪沉积。这一发现与HFD组附睾脂肪组织中脂肪生成标志物 ACC、C/EBPα和SREBP-1c的基因表达显著高于正常组一致。此外,HFD喂食表现为对脂肪组织的炎症损伤。与正常组相比,HFD组脂肪组织中通用的小鼠巨噬细胞标志物F4/80和M1巨噬细胞标志物Fpr2和CD11c的基因表达显著更高。所有测试剂处理HFD喂养小鼠导致脂肪细胞的平均直径和面积显著下降。此外,HFD组的脂肪生成标志物的脂肪组织基因表达也被测试剂显著降低,但不同的是,P.B、L.B和L.A处理后ACC的基因表达显著降低;P.A处理后C/EBPα和SREBP-1c的基因表达显著降低。测试剂还揭示HFD喂养动物脂肪组织中的抗炎活性,因为P.B、L.B、P.A和L.A处理抑制巨噬细胞标志物F4/80和Fpr2,但不是Xen。
A. muciniphila改善HFD诱导小鼠的肠道结构、炎症和屏障完整性
对AB/PAS染色的结肠组织进行组织学评估,以检查测试剂对HFD喂养小鼠肠道结构的影响。喂养HFD导致动物肠道组织的组织学结构显著破坏。特别是,在显示AB/PAS阳性染色的上皮细胞中,隐窝深度和杯状细胞计数在HFD喂养后显著降低。此外,与正常组相比,HFD组的粘液层厚度显著降低。结果表明,HFD喂养对肠道造成炎症损伤,结肠中炎症标志物MCP1的基因表达显著增加就证明了这一点。另一方面,虽然变化不显著,但HFD喂养后肠道TNF-α的mRNA水平显著增加。Toll样受体(TLR)家族成员在先天免疫和炎症反应中发挥重要作用。HFD组肠道TLR2和TLR4基因表达水平明显高于正常组。肠道ZO-1、ZO-2、claudin 1和claudin 2是帮助维持肠道屏障完整性的重要上皮紧密连接(TJ)蛋白,其基因表达水平在HFD组中显著低于正常组。另一方面,在正常组和HFD组之间,肠道激素PYY(一种具有厌食作用和减轻体重的肽)的基因表达没有观察到显著差异。G蛋白偶联受体(GPCRs)GPR41和GPR43在介导宿主与肠道微生物群之间的相互作用以及作为食欲调节剂方面发挥着重要作用。在动物中没有观察到肠道中这两种蛋白质的基因表达对HFD的反应有显著变化。
这些结果表明,受试药物对HFD喂食小鼠的肠道炎症和结构异常具有明显的保护活性,但程度不同。将L.B、P.A和L.A处理HFD喂食小鼠,而不是Xen或P.B,导致杯状细胞计数和隐窝深度显著增加。用所有测试剂处理HFD喂食小鼠导致肠道中粘液层厚度和ZO-1和claudin 2的基因表达显著增加,并且MCP1和TLR2基因的结肠表达显著降低。这些测试剂对HFD组肠道其他蛋白基因表达的显著影响如下:P.A处理下调TNF-α;P.B、L.B和L.A处理抑制TLR4;Xen处理增加ZO-2;Xen和L.A处理上调claudin 1。
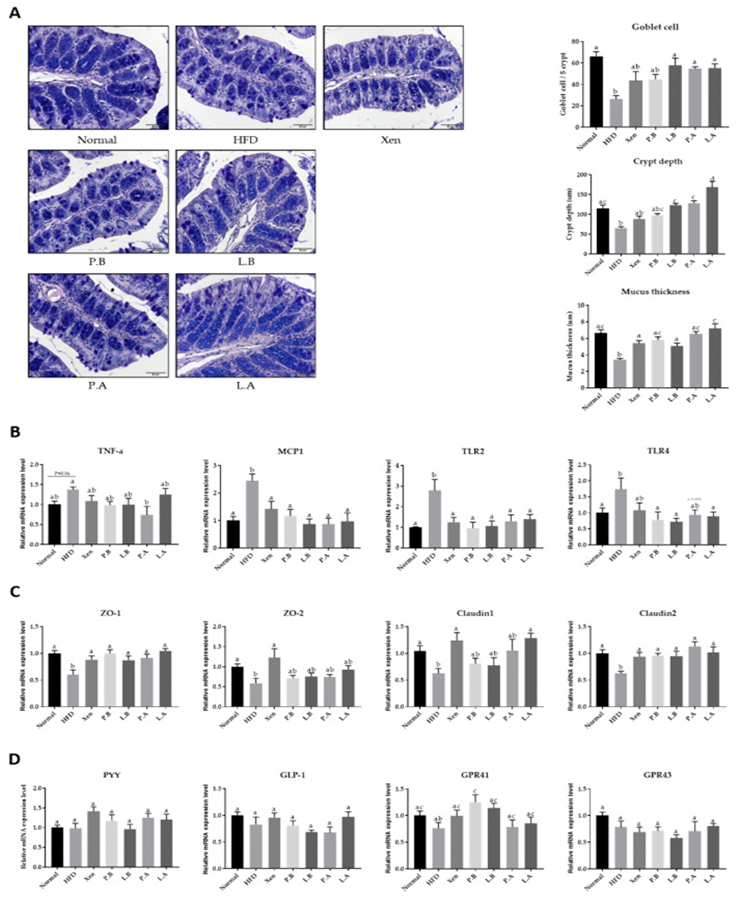
图上 施用细菌改善肠道结构、通透性和炎症,但没有显著改变食欲调节因子的基因表达水平
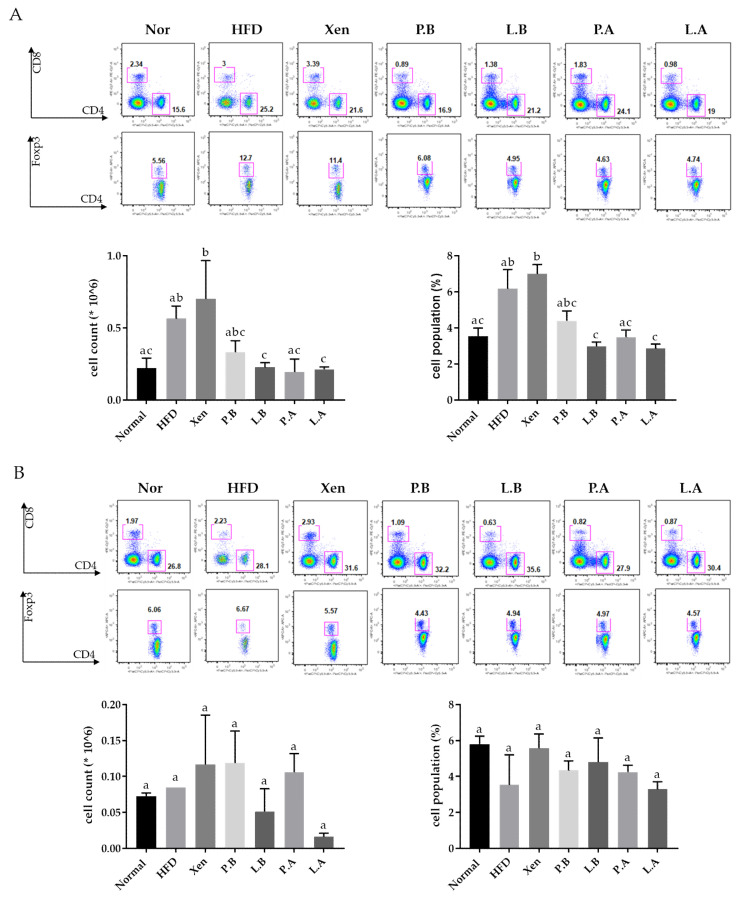
图下 脾脏(A)和MLN(B)组织中的Treg细胞数量和数量
A. muciniphila减少HFD组中脾Treg细胞的数量
该研究揭示HFD喂养小鼠脾脏中Treg细胞(CD4+Foxp3+)的数量和种群(%)的显著增加。另一方面,L.B、P.A和L.A以及L.B和L.A处理HFD喂养小鼠分别显著减少脾Treg细胞的数量和种群。然而,在MLN组织中,正常组和HFD组中Treg细胞的数量和种群相似。特别是,用L.A处理HFD喂养小鼠导致MLN中Treg细胞计数显著减少。除此之外,测试剂对HFD组MLN中的Treg细胞数量和喂养小鼠没有其他显著影响。
结论
给小鼠服用活的和巴氏杀菌的AKK菌两种菌株都通过防止一周后体重增加来改善HFD引起的小鼠肥胖和代谢失调。此外,它们导致主要脂肪组织的重量、脂肪生成/脂肪生成和血清TC水平的降低、葡萄糖稳态的改善和炎症损伤的抑制。这些处理恢复了受损的肠道结构和完整性,并改善HFD喂养小鼠的肝脏结构和功能。另一方面,对于这两种菌株,巴氏杀菌形式在改善葡萄糖耐量方面比活形式更有效。此外,特定的AKK菌含有活菌或巴氏杀菌菌的制剂显著降低了HFD喂养动物的脾Treg细胞(CD4+ Foxp3+)的数量和种群(%),进一步支持了这些细菌的抗炎特性。总体而言,该研究结果清楚地表明,与活菌相比,使用巴氏杀菌形式的AKK菌的治疗效力没有损失。此外,总的来说,这种益生菌对抗肥胖和代谢失调的效率优于奥利司他。

「文章仅供学术探讨,如需转载请注明出处。」
 yzh@akkpro.com
yzh@akkpro.com


