关键词:AKK菌、AKK菌格林汁
特应性皮炎(AD),又名特应性湿疹,是一种常见于婴儿和儿童的慢性炎症性疾病,通常会持续到成年,为患者带来了严重的身体、心理、生活负担。
在AD的发病机制中,过敏原暴露导致T辅助2(Th2)细胞释放炎性细胞因子,导致Th1和Th2细胞之间的不平衡,从而增加免疫球蛋白E(IgE)的产生。这些反应最初由胸腺基质淋巴细胞生成素(TSLP)驱动,随后触发树突状细胞介导的Th2炎症反应。虽然目前外用类固醇作为AD的主要治疗手段,但长期使用会导致皮肤干燥、皮肤厚度减少、血压升高、肾功能下降等严重的副作用。

因此,有必要开发一种从婴儿到老年人的安全有效的AD治疗方法。AD的人源微生物组研究应发展为更安全、更有效的AD治疗。
最近的研究表明肠道菌群失调与AD之间存在相关性。肠道菌群失调的代谢物可以进入循环系统并在皮肤中积聚,损害表皮分化和皮肤屏障的完整性,最终对皮肤功能产生负面影响。在一项临床研究中,对AD患者粪便样本的宏基因组分析显示,与对照患者相比,普拉梭菌(Faecalibacterium prausnitzii)种类显著减少,并且在AD患者中观察到粪便短链脂肪酸(SCFA),尤其是丁酸盐的减少。F. prausnitzii是一种生活在人体肠道中的专性厌氧菌,约占健康成年人肠道微生物群的5%。该物种是丁酸盐生产者,影响生理功能和体内平衡以维持健康,它的抗炎活性已得到充分证实。同时,Akkermansia muciniphila也是一种专性厌氧菌和粘蛋白降解细菌,广泛存在于健康的人体肠道黏膜中,占肠道微生物群的3%。它产生SCFA,主要是丙酸盐和乙酸盐,并能够调节宿主的新陈代谢、免疫反应和肠道屏障功能。
最近的研究报告称,过敏性哮喘和AD儿童的肠道菌群中F. prausnitzii和A. muciniphila的丰度分别降低,这些细菌的分泌代谢物可能会诱导抗炎和预防促炎细胞因子。然而,这些细菌的临床效果尚未完全阐明。该项研究通过使用2,5-二硝基氯苯(DNCB)诱导AD模型,评估F. prausnitzii和A. muciniphila在具有AD样症状的NC/Nga小鼠中的作用。
F. prausnitzii和A. muciniphila的施用改善了AD相关标志物,例如皮炎评分、搔抓行为和血清免疫球蛋白E水平。补充F. prausnitzii EB-FPDK11或A. muciniphila EB-AMDK19可能是AD患者的新治疗选择,其中EB-AMDK19似乎具有最高的潜力。
F. prausnitzii和A. muciniphila菌株从7至60岁的健康韩国人身上采集新鲜粪便样本进行分离培养。使用PacBio RS II测序平台对F. prausnitzii EB-FPDK11和A. muciniphila EB-AMDK19的全基因组进行测序。F. prausnitzii参考菌株为F. prausnitzii A2-165(DSM17677),A. muciniphila参考菌株为A. muciniphila BAA-835(ATCC BAA-835)。
六周大的雄性NC/Nga(重约21-25克)在20 ± 3 °C、湿度55 ± 5%的恒定温度下以12小时的光照/黑暗循环饲养适应性一周。适应后,所有小鼠分为正常对照(Normal)、DNCB+PBS(DNCB)、DNCB+地塞米松(DEX)、DEX+F. prausnitzii A2-165(A2-165)、DNCB+F. prausnitzii EB-FPDK11(EB-FPDK11)、DNCB+A. muciniphila BAA-835(BAA-835)和DNCB+A. muciniphila EB-AMDK19(EB-AMDK19),n=9。DNCB诱导特应性皮炎模型:适应一周后使用电子剪和脱毛膏去除所有NC/Nga小鼠的背毛,DNCB溶液在丙酮:橄榄油悬浮液(3:1)中以1%的浓度制备,并涂在小鼠耳朵和背侧皮肤,每周两次,持续3周。在EB细菌菌株给药期间用0.5% DNCB涂小鼠,每周两次。A2-165、EB-FPDK11、BAA-835和EB-AMDK 19 组每只小鼠每日口服给药200 μL含1 × 108 CFUs各自菌株的无菌PBS,持续6周。正常组和DNCB组小鼠被施用200 μL无菌PBS。DEX组作为阳性对照,用蒸馏水将地塞米松稀释至60 μg/mL,每天200 μL口服给药。在DNCB处理三周后,每周评估一次皮炎严重程度,测定抓挠频率。在研究的最后一天取实验小鼠的背部皮肤、耳朵和大肠组织进行组织学分析和免疫组织化学分析。在9周处理期结束时,处死小鼠收集血样测定总血清IgE和细胞因子。从肠中分离总RNA进行定量聚合酶链式反应(qPCR)分析。此外还进行短链脂肪酸(SCFA)分析,通过气相色谱(GC)测量接种前培养基和培养物上清液中乙酸盐、丁酸盐、丙酸盐的浓度。
F. prausnitzii和A. muciniphila的细菌菌株该研究从健康的韩国人中分离出约80种不同菌株组成的菌株库,基于例如(1)使用人类细胞系如HT-29 37的抗炎活性,(2)使用Caco-2细胞系的跨上皮电阻(TEER)值,和(3)基于使用小鼠BMDCs产生的IL-10和IL-12的免疫调节活性从F. prausnitzii 菌株库中选择F. prausnitzii EB-FPDK11。A. muciniphila EB-AMDK19菌株在先前的研究中有所描述。该研究进行全基因组测序以表征菌株的基因组特征,显示了两种菌株的基因组特征以及各自的类型菌株(F. prausnitzii ATCC 27768[系统群I类型菌株]、F. prausnitzii A2-165[系统群II类型菌株]和A. muciniphila BAA-835)。简而言之,F. prausnitzii EB-FPDK11 的基因组大小约为2.8 Mb和2579个编码序列(CDS),小于典型菌株的基因组大小。ANI分析表明F. prausnitzii EB-FPDK11分别与ATCC 27768和A2-165具有84.7%和97.5%的序列同一性。同时,A. muciniphila EB-AMDK19的基因组大小约为2.7 Mb,有2195个CDS,比典型菌株大。A. muciniphila EB-AMDK19的ANI分析显示与ATCC BAA-835的序列同一性为97.6%。
口服F. prausnitzii和A. muciniphila减轻DNCB诱导的NC/Nga小鼠AD样症状为研究EB-FPDK11或EB-AMDK19给药是否可以有益地影响AD模型,除正常组外的所有实验组NC/Nga小鼠接受DNCB处理3周,然后各处理组分别接受地塞米松(DEX)、F. prausnitzii A2-165(A2-165)、F. prausnitzii EB-FPDK11(EB-FPDK11)、A. muciniphila BAA-835(BAA-835)或A. muciniphila EB-AMDK19(EB-AMDK19)治疗持续6周,此时小鼠中已经出现AD样病变,包括伴有抓挠、干燥和表皮剥脱的水肿性红斑。用DNCB处理3周导致严重皮炎的发展,在所有实验组中皮炎评分约为8。DNCB组在6周治疗期间皮炎评分几乎没有任何变化,而与DNCB组相比,每日接受地塞米松或108 CFUs相应菌株的组的评分显著降低(DEX:51%;A2-165:32%;EB-FPDK11:34%;BAA-835:53%;EB-AMDK19:69%)。
组织学上,与DNCB组相比,DEX、EB-FPDK11、BAA-835和EB-AMDK19给药大大减轻了耳部皮肤病变的病理变化,如角化过度和炎性细胞浸润,但A2-165组在耳部皮肤病变中没有明显的变化。同样,与DNCB组相比,除了A2-165组在其他治疗组中观察到耳朵厚度显著减少(正常:0.55±0.03 mm,DNCB:1.50±0.07 mm,EB-FPDK11:1.16±0.06 mm,BAA-835:1.1±0.06 mm,EB-AMDK19:0.87±0.04 mm)。同时,对抓挠行为进行计数以评估对皮肤瘙痒的影响。重复局部应用DNCB导致正常组抓挠行为增加7.5倍。相比之下,所有治疗组的抓挠行为均显著减少,与DNCB组相比,EB-FPDK11和EB-AMDK19组分别减少了76.2%和72.9%。
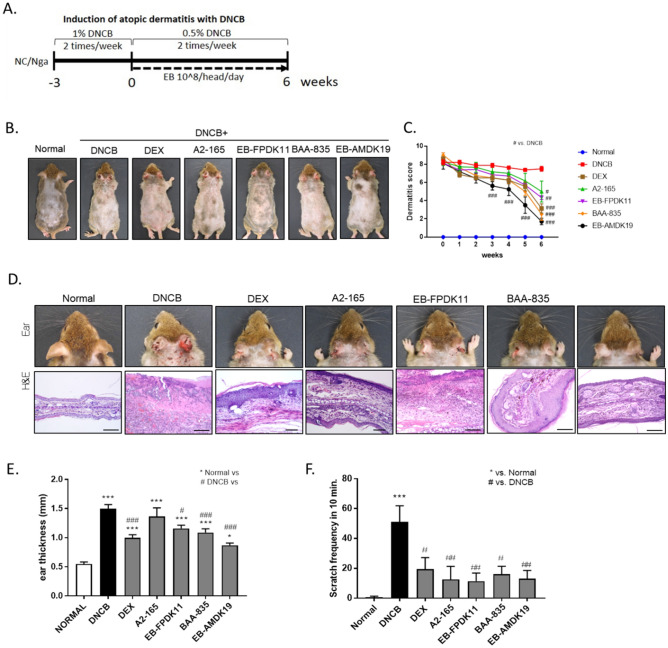
图EB-FPDK11和EB-AMDK19可有效预防NC/Nga小鼠的AD样病变症状

图EB-FPDK11和EB-AMDK19对DNCB诱导的AD样小鼠脾脏和总血清IgE水平的影响
F. prausnitzii和A. muciniphila处理对NC/Nga小鼠IgE水平和炎症细胞浸润的影响该研究进行了一项特应性动物模型实验,每周两次施用1% DNCB持续3周,然后每周两次施用0.5% DNCB持续6周。根据前人研究的说法,这种环境可能会诱导局部和全身免疫反应。AD不仅会引起局部皮肤病变,还会引起全身反应,影响脾脏、骨髓和淋巴结等内部组织和器官。脾脏含有一系列免疫细胞,在调节免疫反应中起着至关重要的作用。因为脾肿大表明免疫系统功能异常,文章研究了EB-FPDK11或EB-AMDK19给药是否影响免疫系统功能。与正常组相比,DNCB组脾脏重量显著增加2.3倍,与DNCB组相比,地塞米松、EB-FPDK11株或EB-AMDK19株治疗显著抑制了脾重。AD发展最显著的特征之一是血清IgE水平升高。与DNCB组相比,所有治疗组的血清IgE水平均显著降低。值得注意的是,EB-AMDK19组的血清IgE降低幅度最大,与BAA-835 组相比甚至更显著(EB-AMDK19:7572±395.3 ng/mL vs BAA-835:13044±1663 ng/mL)。由活化的肥大细胞释放的组胺通过增加血管通透性允许免疫细胞浸润到组织中。因此,为减少AD等自身免疫性疾病中的过敏反应,有必要控制活化的肥大细胞。该研究分别用甲苯胺蓝和刚果红溶液处理各组的背部皮肤组织对肥大细胞和嗜酸性粒细胞进行染色,以检查DNCB诱导的治疗组肥大细胞和嗜酸性粒细胞浸润到皮肤病变中的影响。DNCB局部处理后浸润真皮层的炎症细胞数量增加,与正常组相比,肥大细胞和嗜酸性粒细胞分别增加13.0±1.3倍和14.7±3.9倍。与DNCB组相比,治疗组肥大细胞和嗜酸性粒细胞浸润明显减少。DEX组与BAA-835或EB-AMDK19组的肥大细胞数量无显著差异。有趣的是,EB-AMDK19组的嗜酸性粒细胞数量减少幅度最大,甚至显著低于DEX组。因此,这些结果表明A. muciniphila和F. prausnitzii菌株的施用抑制了DNCB诱导的嗜酸性粒细胞和肥大细胞浸润到皮肤病变中,其中EB-AMDK19似乎是最有效的。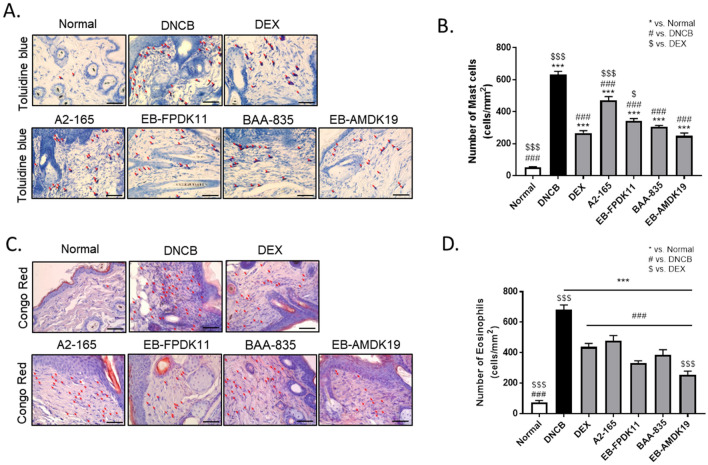
图 EB-FPDK11和EB-AMDK19在DNCB诱导的AD样小鼠中抑制肥大细胞和嗜酸性粒细胞浸润到真皮中图 EB-FPDK11和EB-AMDK19增强NC/Nga小鼠AD样病变中的皮肤屏障蛋白
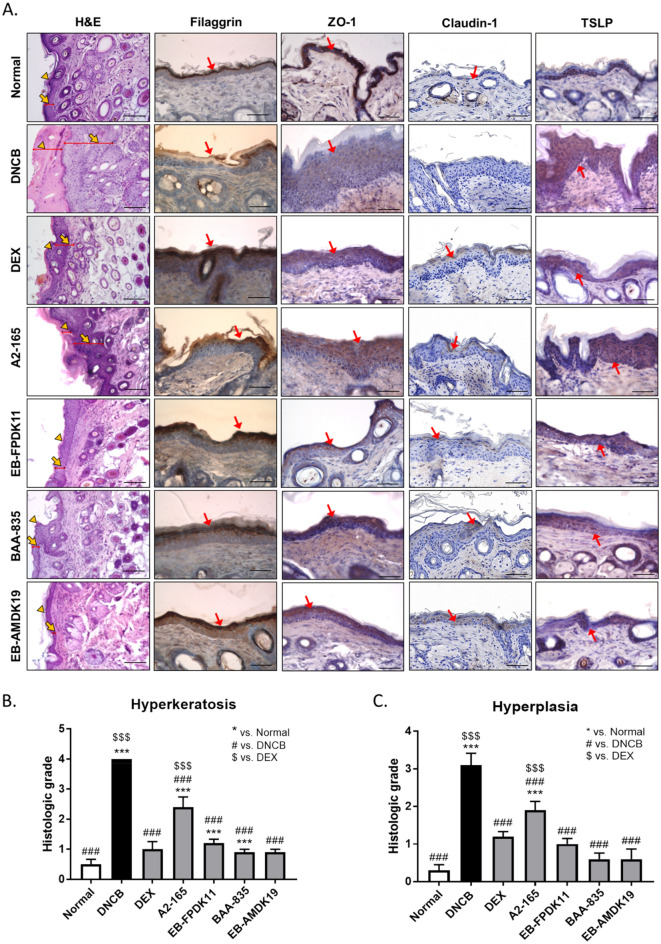
用F. prausnitzii和A. muciniphila菌株治疗的NC/Nga小鼠受损皮肤状况的改善AD的病理生理学涉及皮肤屏障和免疫功能异常。受损的表皮紧密连接(TJ)蛋白,如ZO-1、claudin-1和occludin可以解释皮肤屏障失调的许多后果,例如,AD患者的TJ蛋白水平降低。丝聚蛋白是角质形成细胞衍生自丝聚蛋白原的蛋白质。它在表皮中起着重要的结构和功能作用,有助于皮肤稳态。此外它对AD和过敏性疾病的发展也至关重要,即使没有丝聚蛋白突变,它在AD患者中的表达也显著降低。该研究进行了组织学染色以确定施用菌株对特应性皮肤病变的影响。H&E染色显示DNCB处理后角化过度、增生和AD病变。与正常组相比,DNCB组的表皮厚度增加了3.6倍。与 DNCB 组相比,A. muciniphila和F. prausnitzii菌株的施用显著降低了角化过度和增生。接下来使用免疫组织化学确定丝聚蛋白的表达。与正常组相比,DNCB组皮肤中的聚丝蛋白表达降低,而在用A. muciniphila或F. prausnitzii菌株处理的组中则有所减轻。因为ZO-1和Claudin1在AD患者的皮肤病变中的低表达,该研究使用免疫组织化学检查ZO-1和Claudin-1的表达水平以评估表皮中的TJ屏障功能。DNCB组的ZO-1和claudin-1蛋白水平低于正常组,EB-FPDK11、BAA-835和EB-AMDK19治疗组的恢复与正常组相似。TSLP激活树突状细胞以将辅助T细胞分化为Th2细胞,这对于诱发特应性皮炎的症状至关重要。当测定皮肤中TSLP的水平时,DEX、EB-FPDK11、BAA-835和EB-AMDK19组的水平显著低于DNCB组。此外,使用免疫组织化学测定法测定皮肤中IL-4细胞因子的水平表明,DNCB诱导组的IL-4水平升高,然而,在所有给予EB菌株的组中,IL-4水平显著降低,包括阳性对照地塞米松。因此,这些发现表明EB-FPDK11和EB-AMDK19给药可通过调节丝聚蛋白、ZO-1、Claudin-1、TSLP和IL-4有效减少DNCB诱导的皮肤屏障异常。通过用F. prausnitzii和A. muciniphila菌株治疗DNCB诱导的AD样小鼠调节Th1和Th2细胞因子之间的平衡AD的特点是主要的Th2免疫反应源自多种细胞因子,包括IL-4和IL-13。特别是,IL-4是 Th2 细胞分化和IgE产生的关键Th2细胞因子。IL-6由活化的T细胞和巨噬细胞分泌,并通过诱导IL-4启动幼稚CD4+T细胞向Th2细胞的极化。最近的临床研究显示抑制IL-6受体可改善AD。当测定与Th2反应相关的IL-4和IL-6细胞因子水平的变化时,与正常组相比,DNCB组血清中的相应细胞因子显著升高,但在菌株给药组显著被抑制。相比之下,与DNCB组相比,治疗组中IL-10的水平几乎没有任何变化,IL-10在AD中起抑制作用。该研究还测定了与Th1反应相关的IL-12和IFN-γ的各自水平,发现与正常组相比它们在DNCB组中显著下调。与DNCB组相比,所有治疗组的IL-12水平均显著升高。特别是EB-AMDK19组的IL-12水平显著高于BAA-835组。同时,与DNCB组相比,仅EB-AMDK19组的IFN-γ水平显著升高。最近关于特应性和哮喘的研究表明,总IgE水平与产生IL-4/IFN-γ的细胞的比率呈正相关。此外,Th2细胞介导的免疫反应比Th1细胞介导的免疫反应更普遍,并且在AD发病机制中发挥重要作用。这些发现表明Th2/Th1平衡与特应性状态有关。因此,实验研究了菌株治疗对Th2/Th1免疫平衡的影响,并分析Th2和Th1相关细胞因子的比例。与正常组相比,DNCB组的Th2/Th1、IL-4/IFN-γ比值平均增加了约1.3倍。所有处理组都抑制了Th2/Th1比率的增加。因此,这些结果表明给予F. prausnitzii和A. muciniphila菌株可以抵消DNCB诱导的免疫反应的不平衡。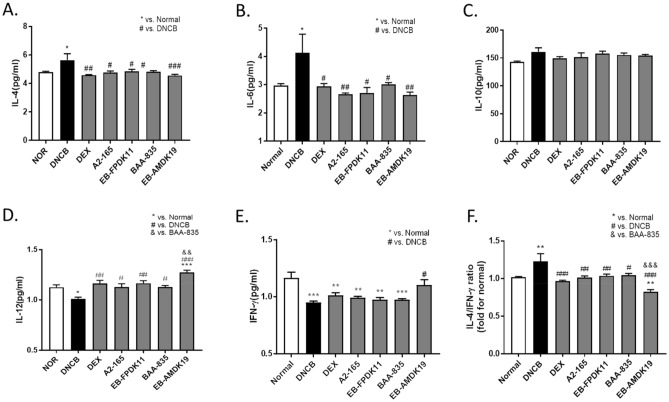
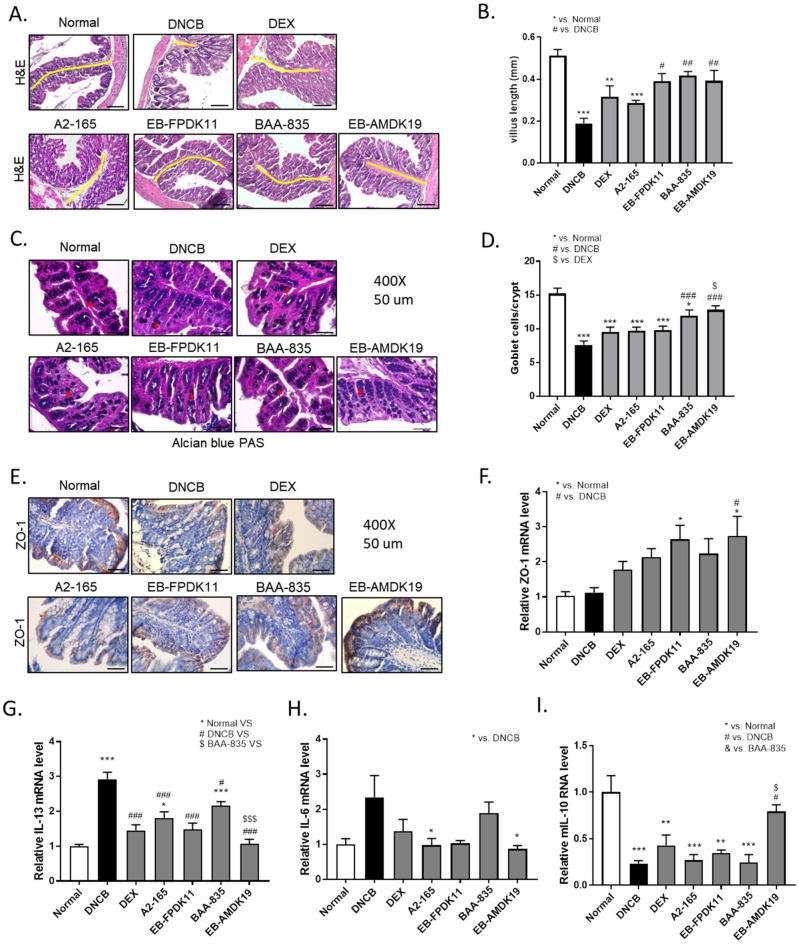
图口服EB-FPDK11和 EB-AMDK19可减轻DNCB诱导的AD(如Nc/Nga小鼠)中的Th2/Th1细胞因子失衡图 EB-FPDK11和EB-AMDK19促进DNCB诱导的结肠损伤维持肠上皮屏障功能用EB-FPDK11和EB-AMDK19治疗NC/Nga小鼠减轻DNCB诱导的结肠损伤该研究检查了结肠形态和肠道屏障功能,以研究菌株对DNCB诱导的肠道屏障功能障碍的影响。结肠H&E染色显示DNCB处理引起严重的黏膜损伤:与正常组相比,由于炎症绒毛形状不规则,并且长度显著缩短(DNCB:0.19±0.02 mm vs正常:0.51±0.03 mm)。与DNCB组相比,治疗组的绒毛长度似乎有所恢复,并且仅在EB-FPDK11、BAA-835和EB-AMDK19 组中显著。杯状细胞是柱状上皮细胞,负责分泌粘蛋白并起到保护上皮的肠道屏障的作用。因此,该研究调查了实验组中杯状细胞是如何受到影响的。结肠组织用阿尔新蓝/PAS染色后发现,DNCB组杯状细胞数量较正常组减少2倍。而与DNCB组相比,BAA-835组和EB-AMDK19组杯状细胞数量分别显著增加1.6倍和1.7倍。接下来使用免疫组织化学检查结肠中ZO-1蛋白的表达水平,发现仅在EB-AMDK19组中表达水平明显增加。为验证这一点,该研究还在转录水平测量了ZO-1的表达,发现它在DEX、A2-165和BAA-835组中趋于增加,或者在EB-FPDK11和EB-AMDK19组中显著增加。这些结果表明,施用EB-FPDK11或EB-AMDK19不仅减轻了DNCB诱导的结肠损伤,而且改善了由过敏性化合物引起的肠屏障功能障碍。最后,该研究通过qPCR量化结肠中抗炎(IL-10)或促炎(IL-6和IL-13)细胞因子的水平来研究对肠道黏膜免疫细胞的影响。与正常组相比DNCB组中IL-13相对mRNA水平显著升高2.9倍,治疗组较DNCB组显著降低,EB-AMDK19 组中IL-13相对mRNA水平最低。IL-6水平也显示出与IL-13相似的趋势,但这仅在A2-165和EB-AMDK19组中显著。相比之下,与正常组相比DNCB组中IL-10的相对mRNA水平显著降低77% ±3%,并且仅在EB-AMDK19 组中上调,显示出3.39倍的增加。
总之,该研究结果表明,F. prausnitzii和A. muciniphila的施用改善了AD相关标志物,例如皮炎评分、搔抓行为和血清免疫球蛋白E水平。此外,F . prausnitzii和A. muciniphila治疗降低了胸腺基质淋巴细胞生成素(TSLP)的水平,触发了T辅助(Th)2细胞因子的产生,并改善了DNCB诱导的Th1和Th2免疫反应之间的不平衡。同时,菌株的口服给药增强了皮肤中丝聚蛋白和肠道屏障中ZO-1的产生,从而导致功能恢复。特别是,EB-AMDK19或EB-FPDK11的改进似乎分别优于BAA-835或A2-165。主要是,EB-FPDK11和EB-AMDK19 与广泛用于AD治疗的类固醇药物地塞米松相比,在抗过敏作用方面似乎具有相似或更好的功效。因此,补充F. prausnitzii EB-FPDK11或A. muciniphila EB-AMDK19可能是AD患者的新治疗选择,其中EB-AMDK19似乎具有最高的潜力。然而,需要进行临床研究以确认EB-FPDK11和EB-AMDK19在人体中的功效。

文章仅供学术探讨,如需转载请注明出处。






 yzh@akkpro.com
yzh@akkpro.com


