欢迎您访问爱非克(深圳)生物科技有限公司
关键词:AKK菌、AKK菌格林汁
冠状动脉疾病是全球最常见的健康问题,并且是导致发病率和死亡率的主要原因。
AAA常见的定义是腹主动脉前部或横截面的最大直径大于3 cm,或局灶性扩张大于正常相邻动脉节段直径的1.5倍。它在人和动物模型中的病理表现为明显的免疫细胞浸润和促炎细胞因子表达上调,表明炎症在AAA形成中起重要作用。功能富集分析显示粒细胞集落刺激因子(G-CSF)、乳脂肪球-EGF因子8蛋白(MFG-E8)、巨噬细胞炎症蛋白1g(MIP-1g)和心肌营养素1(CT-1)的水平与AAA小鼠的IL-33、骨膜素、基质金属蛋白酶1 (MMP-1)、基质金属蛋白酶9(MMP-9)、组织蛋白酶B(CTSB)和组织蛋白酶L(CTSL)呈正相关。IL-33是一种具有多种免疫调节作用的多效性细胞因子,外源性IL-33(每天腹腔内给予重组IL-33或转基因IL-33表达)通过增强ST2依赖性主动脉和全身调节性T细胞扩增保护小鼠免受AAA形成的影响。这些研究表明,这些细胞因子可能通过影响蛋白酶活性参与AAA的形成,为研究AAA的生物标志物和分子机制提供了一系列有意义的靶点。
肠道微生物群
在多种心血管疾病中发挥重要作用,例如与AAA相关的动脉粥样硬化和高血压。

AKK菌能通过恢复肠道屏障来改善代谢性内毒素血症引起的炎症,从而减少动脉粥样硬化病变。先前研究已经证实AKK菌在AAA患者或小鼠的肠道中被耗尽。AAA小鼠肠道菌群的16S rRNA基因序列分析显示,正常小鼠和AAA小鼠肠道菌群不同,AKK菌、Odoribacter、螺杆菌属和瘤胃球菌属的变化可能参与了AAA的发展。
AKK菌
是一种稳定定植于肠道粘液层的肠道共生菌,被认为是下一代益生菌的候选菌株之一,它能有效改善宿主体内的新陈代谢和免疫功能,可用于治疗肠道微生物组相关疾病。
临床数据表明,口服AKK菌是安全的,但其效果需要在更大样本量的临床试验中进一步验证。然而,作为一种新型益生菌,AKK菌在AAA疾病发生中的作用仍不清楚。
研究实验
该研究使用C57BL/6J小鼠构建AAA模型,采用AKK菌治疗AAA小鼠,利用16S rRNA基因序列分析肠道菌群功能和细胞因子表达,以阐明AKK菌治疗AAA的潜在机制。
结果表明AAA病的发生可能伴有炎性细胞因子表达增加、肠道菌群多样性降低、严重的局部免疫浸润和腹主动脉弹性纤维降解。AKK菌口服给药可抑制腹主动脉扩张和炎症,恢复肠道菌群多样性,促进外周血免疫和IL-33表达,并调节与乳酸杆菌和l-鼠李糖降解/合成相关的功能通路以抑制AAA的形成。
研究内容
该研究共使用50 只5-6个月大的雄性C57BL/6J小鼠。所有小鼠都被关在笼子里,在22-26°C的温度控制室中饲养,相对湿度为45%-60%,提供标准食物和水,光照和黑暗周期为12/12小时。小鼠随机分为5组,包括对照组、假手术组、AAA组、AAA+Am组、AAA+灭活Am组,10只/组/鼠笼。雄性C57BL/6J小鼠腹腔注射戊巴比妥(40 mg/kg)麻醉,用0.5 mol/L CaCl2处理腹主动脉通道的外表面15分钟构建AAA模型,假手术组小鼠腹腔注射戊巴比妥(40 mg/kg)麻醉后用NaCl(0.9%)诱导。
AAA+Am组和AAA+灭活Am组小鼠通过口服强饲法给予2×108 CFU/180 μl A. muciniphila。AAA组和假手术组小鼠经口灌胃给予相同剂量的无菌PBS,对照组不予处理。
在实验的第28天,收集粪便样本进行16S rRNA基因测序与分析,每组在松鼠笼中收集5个粪便样本,每组10只小鼠。用过量的戊巴比妥(500 mg/kg)处死小鼠,取主动脉(从主动脉弓到髂腹主动脉分叉处)在解剖显微镜下解剖(将主动脉置于装有0.9%生理盐水的培养皿中),去除附着在主动脉外膜上的脂肪和结缔组织,拍摄主动脉并测量腹主动脉的直径。收集不同处理组小鼠腹主动脉组织样品进行酶联免疫吸附试验、免疫组织化学分析、实时逆转录-PCR检测以及蛋白质印迹分析。
研究结果
Akkermansia muciniphila抑制小鼠腹主动脉瘤的形成。
实验设计流程图如下图左A。实验结束后对主动脉瘤的观察表明,与对照组相比,AAA组有主动脉瘤形成,说明AAA模型构建成功。与AAA组相比,AAA+Am组和AAA+灭活Am组主动脉瘤分布减少,表明A. muciniphila抑制了AAA小鼠主动脉瘤的形成。腹主动脉最大直径测量显示AAA组直径最大,A. muciniphila干预后腹主动脉直径明显减小。苏木精-伊红(HE)染色显示AAA小鼠腹主动脉组织中膜变薄,中膜和外膜有明显的炎性细胞聚集。Picrosirius red和van Gieson染色显示血管壁弹性纤维退化,连续性中断,大量炎性细胞侵入隔膜。A. muciniphila的干预改善了AAA小鼠血管壁弹性纤维的损伤,抑制了炎症细胞的浸润,保护了AAA小鼠腹主动脉中隔的完整性。上述结果表明,A. muciniphila可以抑制AAA小鼠主动脉瘤的形成。
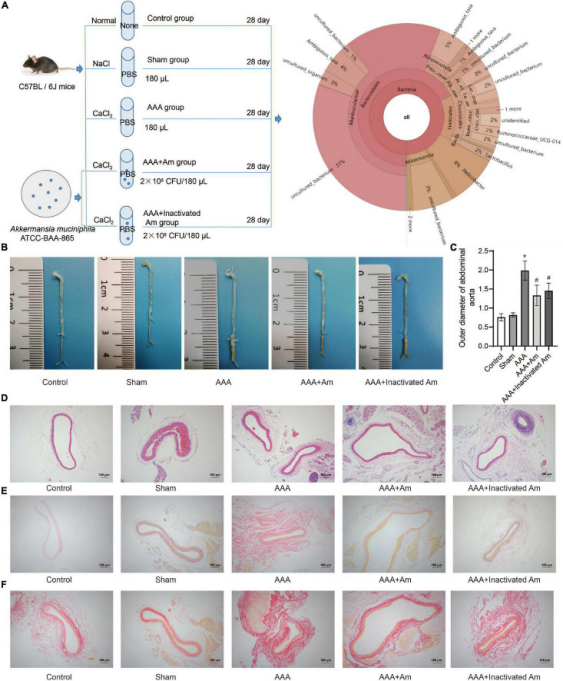 图A. muciniphila抑制AAA的形成
图A. muciniphila抑制AAA的形成
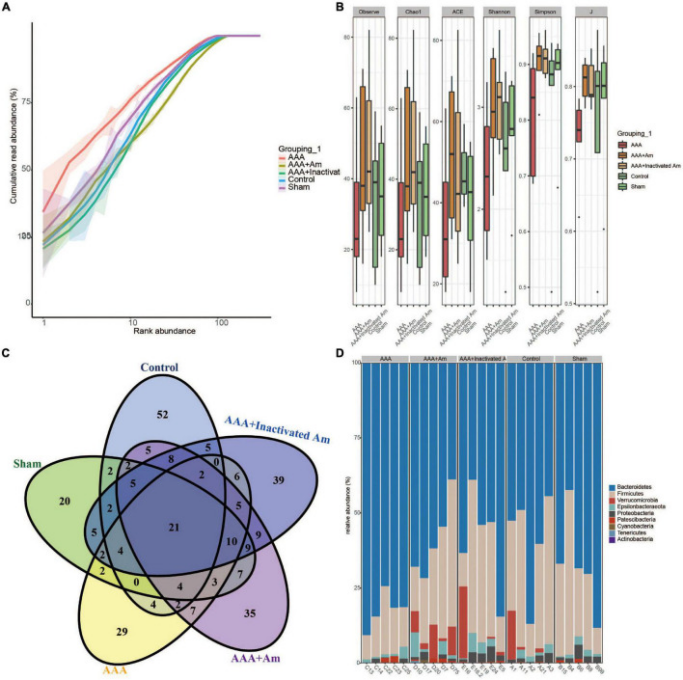
图A. muciniphila影响肠道微生物群的多样性
rank丰度曲线显示,随着测序深度的增加,每个样本的read丰度呈指数增长并达到平台期,表明测序深度足够。根据α多样性指数分析,与对照组相比,AAA组肠道菌群的微生物多样性降低。A. muciniphila的干预增加了AAA小鼠肠道菌群的α多样性指数。维恩图分析显示,对照组、假手术组、AAA组、AAA+Am组和AAA+灭活Am组分别注释了118、98、101、134和132个微生物群。在门水平上对拟杆菌门、厚壁菌门、疣微菌门、Epsilonbacteraeota、变形杆菌门、Patescibacteria、蓝藻门、软壁菌门和放线菌门进行了注释。热图显示排名前20的门主要属于拟杆菌门、疣微菌门、厚壁菌门和变形菌门。在属水平上对毛螺菌科NK4A136组、乳杆菌属、Akkermansia、Alloprevotella、螺杆菌属、Allobaculum、普雷沃氏菌属9、另枝菌属、Muribaculum、瘤胃梭菌属、普雷沃氏菌科UCG_001属、脱硫弧菌属、嗜木聚糖真杆菌组和Parabacteroides进行了注释。结果表明,A. muciniphila的干预增加了AAA小鼠肠道微生物群的多样性。
图A. muciniphila影响肠道微生物群的多样性
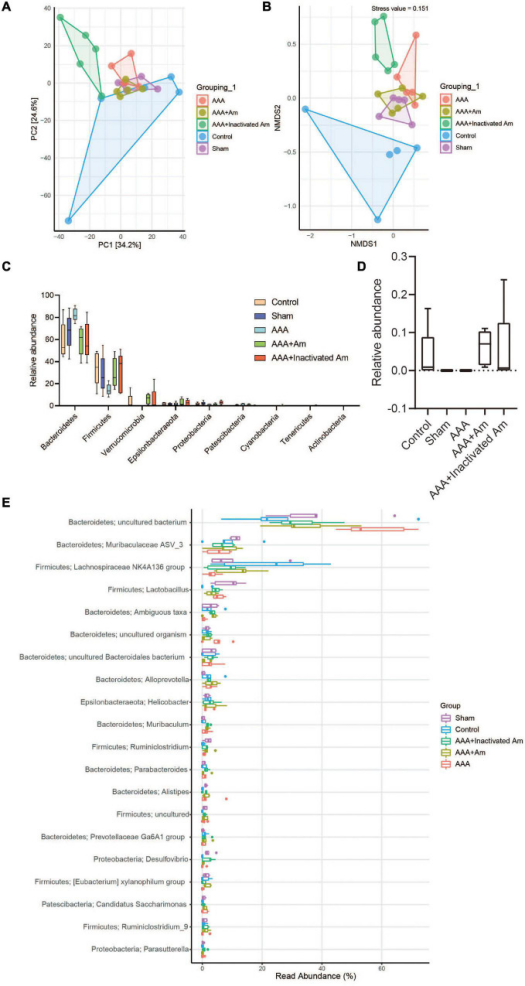
图A. muciniphila影响肠道微生物群的组成
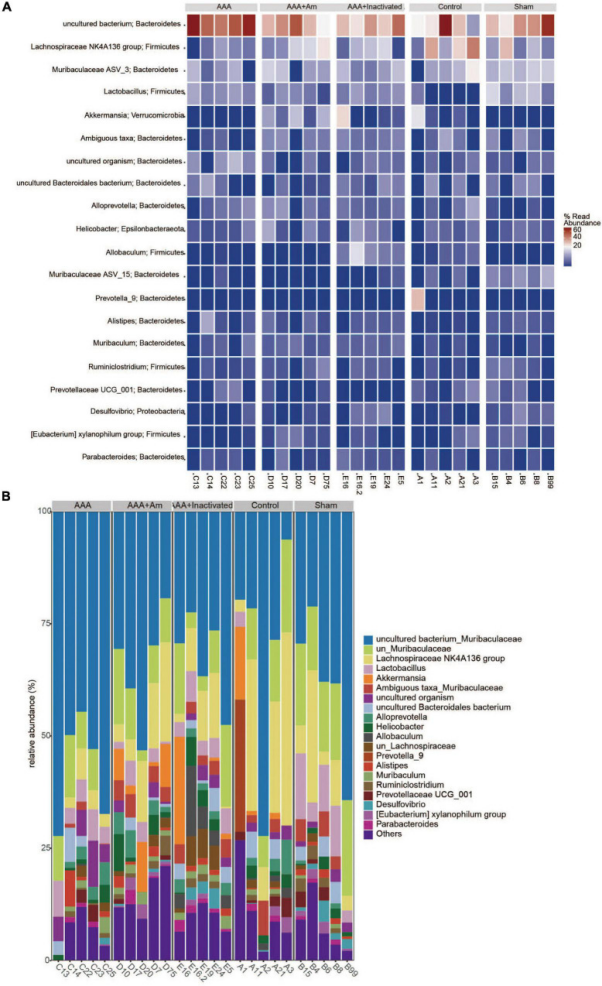
主成分分析(PCA0显示PC1=34.2%和PC2=24.6%,表明A. muciniphila解释了微生物群组成差异的58.8%。非度量多维标度(NMDS)分析表明应力值等于0.151且小于0.2,组间差异程度显著。与对照组相比,AAA组的拟杆菌门和巴氏杆菌门增加,而厚壁菌门、疣微菌门和变形杆菌门减少。与AAA组相比,AAA+Am组拟杆菌门和Patescibacteria的丰度降低,而厚壁菌门和疣微菌门的丰度增加。AAA+灭活Am组结果与AAA+Am组一致。与对照组相比,AAA组属水平上阿克曼氏菌的相对丰度降低。A. muciniphila的干预提高了 AAA+Am和AAA+灭活Am组中Akkermansia的相对丰度。与对照组相比,AAA组的拟杆菌门-未培养细菌和厚壁菌门-乳酸杆菌丰度增加,而厚壁菌门-毛螺菌科NK4A136组丰度降低。用A. muciniphila处理AAA小鼠后,拟杆菌门-未培养细菌和厚壁菌门-乳酸杆菌丰度降低,而厚壁菌门-毛螺菌科NK4A136组丰度增加。A. muciniphila改变了肠道微生物群的结构,可能与未培养的细菌、乳酸杆菌和毛螺菌科NK4A136组的丰度有关。
与对照组相比,AAA组腹主动脉组织中MMP-1、MMP-9、CTSB、CTSL水平显著升高。A. muciniphila干预后,腹主动脉组织中MMP-1、MMP-9、CTSB、CTSL 水平显著降低。腹主动脉组织中IL-33分布的免疫组织化学(IHC)分析显示,与对照组相比,AAA组IL-33的表达明显升高。A. muciniphila干预后,IL-33的表达较AAA组明显降低。qRT-PCR分析IL-33表达结果,腹主动脉组织Western blot结果与IHC结果一致。ELISA法检测外周血炎症因子结果显示,与对照组相比,IL-4、IL-10、IL-17A水平显著降低,而IL-6、IFN-γ和C-反应蛋白(CRP)在AAA组显著升高。A. muciniphila干预后,与AAA组相比,IL-4、IL-10、IL-17A水平显著升高,而IL-6、IFN-γ和CRP水平显著降低。与对照组相比,AAA组PCNA和OPN的表达明显降低,而α-SMA的表达明显升高。与AAA组相比,A. muciniphila处理AAA小鼠PCNA和OPN的表达显著升高,而α-SMA的表达显著降低。证明A. muciniphila可能通过调节AAA小鼠腹主动脉中IL-33和免疫因子的表达来抑制AAA的形成。
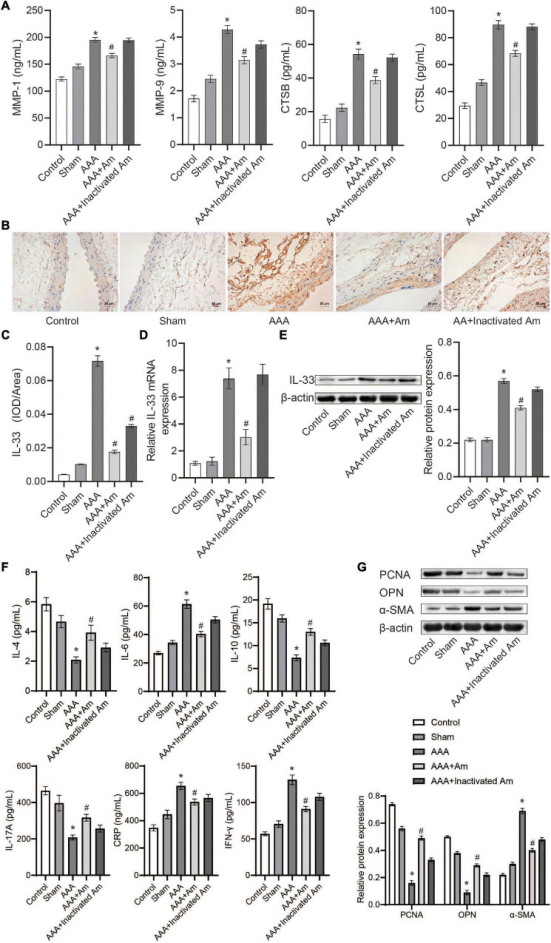
图A. muciniphila调节免疫因子的表达
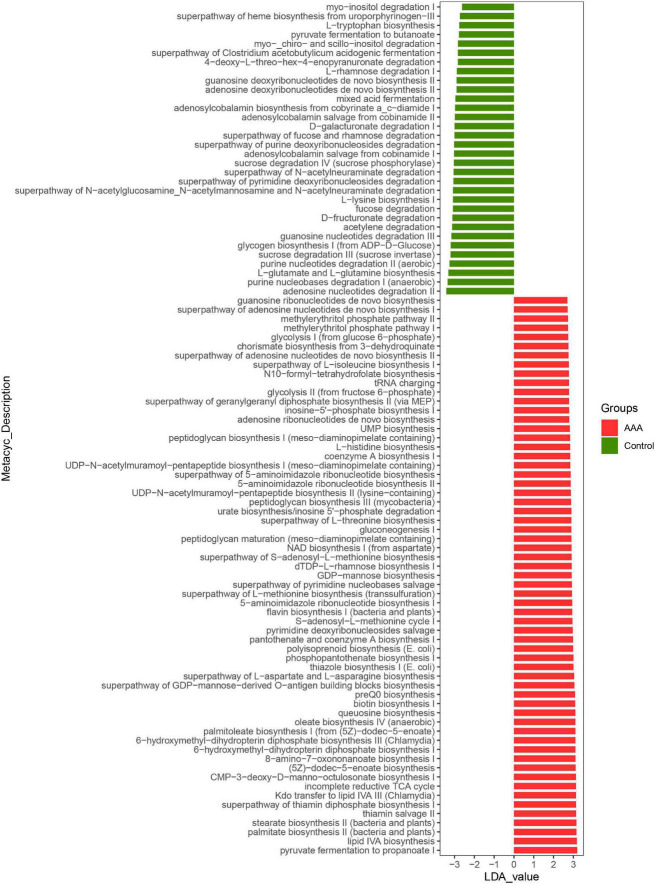
图LefSe分析了A. muciniphila对对照组和AAA组肠道菌群功能的影响
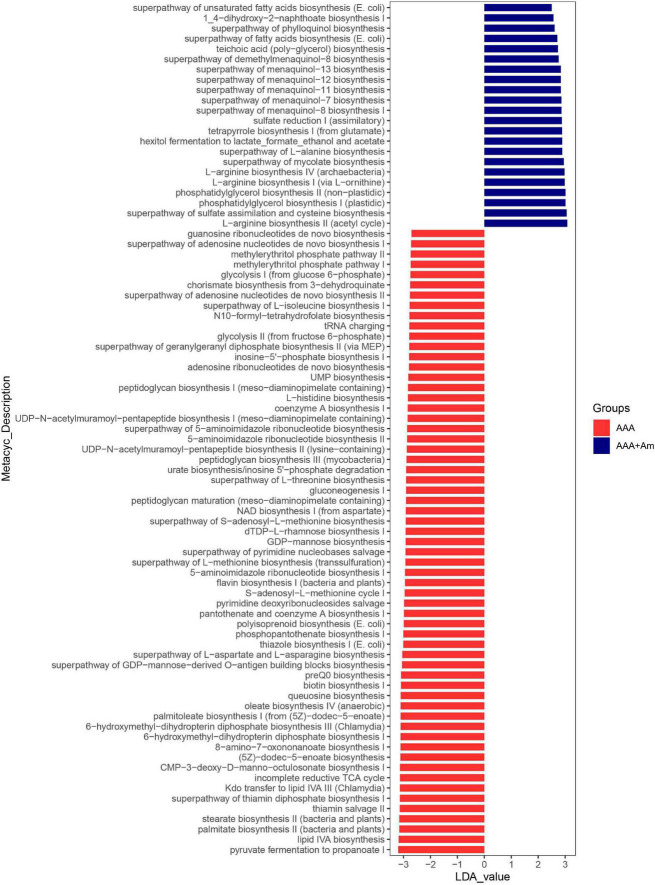
图LefSe分析了A. muciniphila对AAA组和AAA + Am组肠道菌群功能的影响
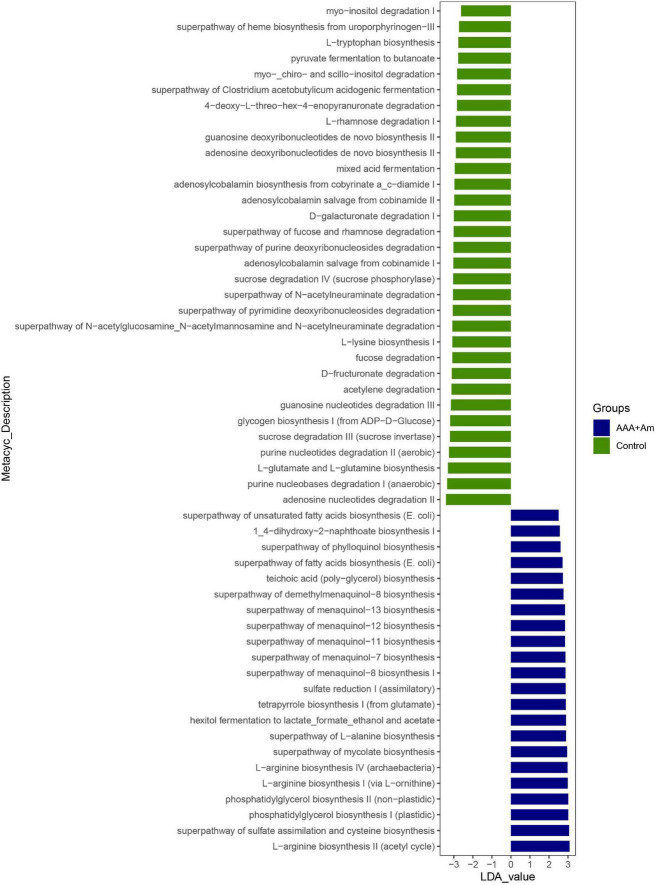
图LefSe分析了A. muciniphila对对照组和AAA + Am组肠道菌群功能的影响
最后,该研究使用Spearman相关性分析了Akkermansia与肠道菌群在属水平上的相关性。Akkermansia在属水平上与双歧杆菌属、肠杆菌属、拟杆菌属、Muribaculum、Alloprevotella、普雷沃氏菌属9、普雷沃氏菌科Ga6A1组、Rikenella、Parabacteroides、Clostridium sensu stricto_1 、Family XIII UCG_001、Eubacterium nodatum group、ASF356、Anaerostipes、Peptococcus、Coprococcus_2、Lachnoclostridium、Lachnospiraceae NC2004 group、Roseburia、Lachnospiraceae NK4A136 group、Marvinbryantia、Lachnospiraceae UCG_001、Eubacterium fissicatena group、Eubacterium ventriosum group、Romboutsia、Intestinimonas、Oscillibacter、Ruminiclostridium_5、Ruminiclostridium_6、Quinella、Ruminococcaceae UCG_004、Ruminococcaceae UCG_005、Allobaculum、Candidatus Saccharimonas、Ruminococcaceae UCG_010、Ruminococcus_1、Ruminococcaceae UCG_013、Ruminococcaceae UCG_014、Erysipelatoclostridium、Dubosiella、Ruminococcus_2、Eubacterium coprostanoligenes group、Parasutterella、Escherichia Shigella和 Anaeroplasma正相关。Akkermansia在属水平上与Odoribacter、Prevotellaceae NK3B31 group、Prevotellaceae UCG_001、Alistipes、Helicobacter、Lactobacillus、Candidatus Arthromitus、A2、Blautia、GCA_900066575、Lachnospiraceae UCG_006、Eubacterium oxidoreducens group、Angelakisella、Butyricicoccus、Harryflintia、Ruminiclostridium、Ruminiclostridium_9、Ruminococcaceae NK4A214 group、脱硫弧菌负相关。
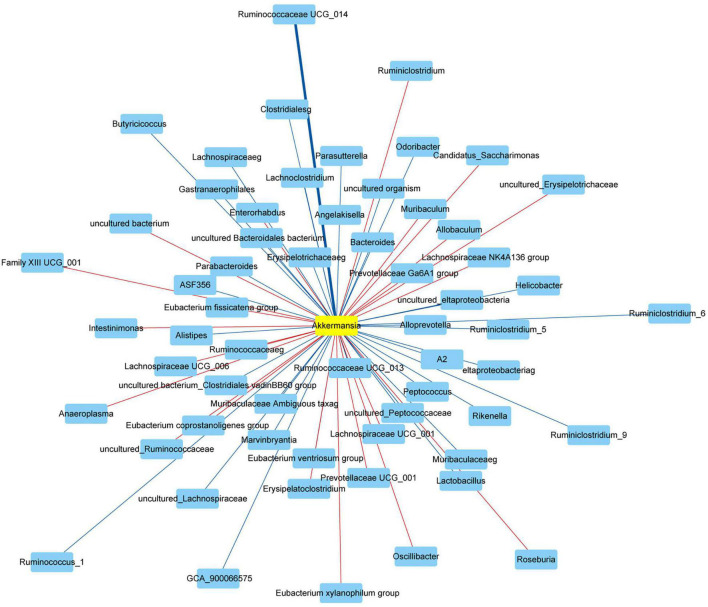
图 网络显示了Akkermansia和肠道微生物群之间的相关性
AAA病的发生可能伴有炎性细胞因子表达增加、肠道菌群多样性降低、严重的局部免疫浸润和腹主动脉弹性纤维降解。A. muciniphila口服给药可抑制腹主动脉扩张和炎症,恢复肠道菌群多样性,促进外周血免疫和IL-33表达,并调节与乳酸杆菌和l-鼠李糖降解/合成相关的功能通路以抑制AAA的形成。

文章仅供学术探讨,如需转载请注明出处。
 yzh@akkpro.com
yzh@akkpro.com


